
|
Notatki z wykładów, ściągawki
Anestezjologia i resuscytacja. Notatki z wykładu: krótko, najważniejsze
Katalog / Notatki z wykładów, ściągawki Spis treści
Wykład nr 1. Pojęcie resuscytacji Resuscytacja to dział medycyny klinicznej zajmujący się problematyką rewitalizacji organizmu, opracowując zasady profilaktyki stanów terminalnych, metody resuscytacji i intensywnej terapii. Praktyczne metody rewitalizacji ciała łączy koncepcja „resuscytacji”. Resuscytacja (z łac. „odrodzenie” lub „animacja”) to system środków mających na celu przywrócenie poważnie uszkodzonych lub utraconych funkcji życiowych organizmu i wyprowadzenie go ze stanu terminalnego i śmierci klinicznej. Skuteczne środki resuscytacyjne to pośredni masaż serca i sztuczna wentylacja płuc. Jeśli nie będą skuteczne w ciągu 30 minut, stwierdza się śmierć biologiczną. Intensywna terapia to zestaw środków stosowanych w leczeniu ciężkich, zagrażających życiu stanów i obejmuje stosowanie szerokiej gamy środków terapeutycznych, zgodnie ze wskazaniami, w tym wlewów dożylnych, przedłużonej sztucznej wentylacji płuc, stymulacji, dializy itp. Stanem krytycznym jest niemożność utrzymania integralności funkcji organizmu w wyniku ostrej dysfunkcji narządu lub układu, wymagającej wymiany leku lub sprzętu-instrumentu. Stan terminalny to stan graniczny między życiem a śmiercią, odwracalne wygaśnięcie funkcji organizmu, w tym etapy preagony, agonii i śmierci klinicznej. Śmierć kliniczna jest stanem terminalnym, w którym nie ma krążenia krwi i oddychania, aktywność kory mózgowej ustaje, ale procesy metaboliczne są zachowane. W przypadku śmierci klinicznej pozostaje możliwość skutecznej resuscytacji. Czas trwania śmierci klinicznej wynosi od 5 do 6 minut. Śmierć biologiczna to nieodwracalne zatrzymanie procesów fizjologicznych w narządach i tkankach, w których resuscytacja jest niemożliwa. Ustala się go przez kombinację szeregu objawów: brak spontanicznych ruchów, skurcze serca i tętna w dużych tętnicach, oddychanie, reakcje na bolesne bodźce, odruch rogówkowy, maksymalne rozszerzenie źrenic i brak ich reakcji na światło. Wiarygodne oznaki początku śmierci to spadek temperatury ciała do 20 ° C, pojawienie się plam zwłok i stwardnienie mięśni pośmiertnych. Wykład nr 2. Podstawowe manipulacje na oddziale intensywnej terapii Przezskórne nakłucie i cewnikowanie żyły głównej (podobojczykowej). Wskazania: duże objętości terapii wlewowo-transfuzyjnej, żywienie pozajelitowe, terapia detoksykacyjna, dożylna antybiotykoterapia, sondowanie i kontrastowanie serca, pomiar CVP, wszczepienie rozrusznika serca, niemożność cewnikowania żył obwodowych. Przeciwwskazania: naruszenie układu krzepnięcia krwi, proces zapalny i ropny w miejscu nakłucia i cewnikowania, uraz obojczyka, zespół żyły głównej górnej, zespół Pageta-Schrettera. Oprzyrządowanie i akcesoria do nakłuć i cewnikowania: igła punkcyjna, komplet plastikowych cewników, komplet przewodników, strzykawka 10 ml do iniekcji domięśniowych, nożyczki, uchwyt igły, igła chirurgiczna i podwiązka jedwabna, plaster samoprzylepny. Technika. Cewnikowanie odbywa się zgodnie z zasadami aseptyki i antyseptyki, obróbki rąk operatora, pola operacyjnego i stosowania sterylnego materiału. Pacjent jest ułożony poziomo na plecach z rękoma przyłożonymi do ciała i klapą głowy w przeciwnym kierunku. Stosuje się znieczulenie miejscowe - 0,5-1% roztwór nowokainy. Nakłucie najlepiej wykonać po prawej stronie, ponieważ przy nakłuwaniu lewej żyły podobojczykowej istnieje niebezpieczeństwo uszkodzenia piersiowego przewodu limfatycznego. Punkt nakłucia - na granicy wewnętrznej i środkowej trzeciej części obojczyka 2 cm poniżej. Igłę wprowadza się powoli pod kątem 45° do obojczyka i 30-40° do powierzchni klatki piersiowej pomiędzy obojczykiem a I żebrem w kierunku górnej krawędzi stawu mostkowo-obojczykowego. Podczas przechodzenia przez igłę tłok strzykawki jest okresowo dokręcany, aby określić, czy wchodzi do żyły, a wzdłuż igły wstrzykuje się nowokainę. Podczas przekłuwania żyły czasami pojawia się uczucie porażki. Po wejściu do żyły strzykawkę odłącza się od igły, a kaniulę zamyka się palcem. Następnie przez igłę wprowadza się przewodnik na długość 15-20 cm i igłę usuwa się. Przez przewodnik przepuszcza się cewnik o odpowiedniej średnicy i wraz z przewodem wprowadza się do żyły na 6-8 cm, po czym przewodnik jest ostrożnie usuwany. Aby sprawdzić prawidłowe położenie cewnika, podłącza się do niego strzykawkę i pobiera do niego 2-3 ml krwi, po czym zakłada się zatyczkę lub rozpoczyna terapię infuzyjną. Cewnik mocowany jest do skóry jedwabną ligaturą. Aby to zrobić, na cewniku 3-5 mm od skóry wykonuje się rękaw z plastra samoprzylepnego, na którym zawiązuje się jedwab, a następnie przepuszcza przez uszy cewnika i ponownie zawiązuje. Po zamocowaniu cewnika miejsce nakłucia zamyka się aseptyczną naklejką. Powikłania: nakłucie tętnicy podobojczykowej, zator powietrzny, nakłucie jamy opłucnej, uszkodzenie splotu ramiennego, uszkodzenie piersiowego przewodu limfatycznego, uszkodzenie tchawicy, wola i tarczycy, ropienie w miejscu nakłucia. 1. Tracheostomia Wskazania: niedrożność krtani i górnej tchawicy spowodowana niedrożnością guza lub ciała obcego, porażenie i skurcz strun głosowych, ciężki obrzęk krtani, ostra niewydolność oddechowa, aspiracja wymiocin, zapobieganie zamartwicy w ciężkich urazach klatki piersiowej. Narzędzia: 2 skalpele, 2 pęsety anatomiczne i chirurgiczne, kilka kleszczy hemostatycznych, podnośnik, sonda ryflowana, 2 tępe i 1 jednozębny ostry haczyk, rozszerzacz Trousseau lub Deschamps, igły chirurgiczne z uchwytem na igłę. Technika Pacjent leży na plecach, wałek pod ramionami, głowa jest odrzucona do tyłu. Jeśli pacjent jest w stanie asfiksji, wałek zakłada się dopiero w ostatniej chwili, przed otwarciem tchawicy. Miejscowe znieczulenie infiltracyjne wykonuje się 0,5-1% roztworem nowokainy z dodatkiem adrenaliny. W ostrej asfiksji można operować bez znieczulenia. Punkty identyfikacji: kąt chrząstki tarczycy i guzek łuku chrząstki pierścieniowatej. Cięcie skóry, tkanki podskórnej i powierzchownej powięzi wykonuje się od dolnej krawędzi chrząstki tarczycy do wcięcia szyjnego ściśle wzdłuż linii środkowej szyi. Żyła środkowa szyi jest cofana lub podwiązywana, znajdując białą linię, wzdłuż której mięśnie są rozpychane tępo i odsłania się przesmyk tarczycy. Krawędzie nacięcia rozsuwa się za pomocą rozszerzacza Trousseau, na brzeg rany zakłada się ligatury i ostrożnie wprowadza się rurkę tracheostomijną, upewniając się, że jej koniec wchodzi do światła tchawicy. Rana chirurgiczna zostaje zszyta. Rurka mocowana jest na szyi pacjenta za pomocą szyny z gazy, uprzednio przywiązanej do osłony rurki. Włóż dętkę do dętki. 2. Konikotomia Pacjent kładzie się na plecach za pomocą poprzecznego wałka na wysokości łopatek. Głowa pacjenta jest odchylona do tyłu. Po potraktowaniu skóry na przedniej powierzchni szyi roztworem antyseptycznym, krtań mocuje się palcami na bocznych powierzchniach chrząstki tarczycy, a szczelinę między tarczycą a chrząstką pierścieniowatą, w której znajduje się więzadło w kształcie stożka, jest filc. W znieczuleniu miejscowym nasiękowym spiczastym skalpelem wykonuje się poprzeczne nacięcie skóry o długości około 2 cm, wyczuwa się więzadło stożkowe i rozcina lub perforuje. Kaniulę tracheostomijną o odpowiedniej średnicy wprowadza się do utworzonego otworu i mocuje paskiem z gazy wokół szyi. W przypadku braku kaniuli można ją zastąpić kawałkiem gumowej lub plastikowej rurki o odpowiedniej średnicy i długości. Aby zapobiec ześlizgnięciu się tej rurki do tchawicy, jej zewnętrzny koniec przekłuwa się poprzecznie w odległości 2 cm od krawędzi i mocuje paskiem z gazy. Conicotome to metalowa kaniula tracheostomijna o małej średnicy z umieszczonym wewnątrz trzpieniem przebijającym. Po rozcięciu skóry nad więzadłem stożkowym przebija się ją konikotomem, usuwa się trzpień, a kaniulę umieszcza się w pozycji zapewniającej swobodny przepływ powietrza do tchawicy i mocuje. W skrajnych przypadkach, przy niedrożności wejścia do krtani i ostrym naruszeniu dróg oddechowych, można ją przywrócić, wstrzykując do tchawicy 1-2 grube igły o średnicy wewnętrznej 2-2,5 mm wzdłuż linii środkowej poniżej poziomu chrząstka tarczycy. Igły wprowadza się pod ostrym kątem do osi tchawicy, czasami bez znieczulenia miejscowego, na głębokość 1-1,5-2 cm. 3. Nakłucie jamy opłucnej Wskazania: ostra duszność z powodu ucisku płuc przez masywny wysięk z zapaleniem opłucnej lub opłucnej, a także powietrze z odmą zastawkową. Technika Nakłucie wykonuje się w pozycji siedzącej, w warunkach aseptycznych. Do znieczulenia miejsca nakłucia stosuje się 0,5% roztwór nowokainy. Do nakłucia służy gruba igła połączona z gumową rurką. Nakłucie wykonuje się wzdłuż górnej krawędzi żebra, ponieważ naczynia międzyżebrowe znajdują się wzdłuż dolnej krawędzi. Penetracja igły do jamy opłucnej odczuwana jest jako „niepowodzenie w pustce”. Zaaspirowanie płynu wzdłuż igły potwierdza, że koniec igły znajduje się w jamie opłucnej. Za każdym razem, gdy napełniona strzykawka jest oddzielana od gumowej rurki, należy ją zacisnąć za pomocą zacisku hemostatycznego, aby zapobiec zassaniu powietrza atmosferycznego do jamy opłucnej. Pod koniec aspiracji na miejsce nakłucia nakłada się aseptyczny bandaż. Powikłania: uszkodzenie tętnicy międzyżebrowej, naczynia przepony płucnej, nakłucie żołądka lub jelit. Intubacja tchawicy. Wskazania: zwężenie krtani, patologiczny oddech, ostra niewydolność oddechowa, śpiączka II i III stopnia, wysokie ryzyko aspiracji podczas zabiegów chirurgicznych na narządach klatki piersiowej i jamy brzusznej, głowy i szyi, w chorobach gardła, krtani i tchawicy (ostre stany zapalne, nowotwory, gruźlica itp.). Do intubacji używa się laryngoskopu. Składa się z rękojeści i ostrza. Najczęściej używane zakrzywione ostrza, ponieważ są bardziej fizjologiczne. Proste ostrza są używane z długą szyją. Przygotowanie do intubacji obejmuje sprawdzenie sprzętu i prawidłowe ustawienie pacjenta. Należy sprawdzić rurkę dotchawiczą. Mankiet jest testowany poprzez napompowanie go strzykawką o pojemności 10 ml. Sprawdź kontakt ostrza z rękojeścią laryngoskopu i żarówką. Konieczne jest upewnienie się, że odsysanie jest gotowe w przypadku nagłego wydzieliny plwociny, krwawienia lub wymiotów. Pomyślna intubacja zależy od prawidłowej pozycji pacjenta. Głowa pacjenta powinna znajdować się na poziomie wyrostka mieczykowatego intubatora. Umiarkowane uniesienie głowy z jednoczesnym wyprostem w stawie szczytowo-potylicznym stwarza lepszą pozycję do intubacji. Przygotowanie do intubacji obejmuje również obowiązkową preoksygenację. Laryngoskop jest trzymany w ręce niedominującej (dla większości osób jest to lewa), a drugą ręką szeroko otwiera się usta pacjenta. Ostrze jest wprowadzane wzdłuż prawej strony części ustnej gardła, aby uniknąć uszkodzenia zębów. Język jest przesunięty w lewo, a ostrze uniesione do łuku gardła. Końcówka zakrzywionego ostrza wprowadzana jest do doliny (dołek znajdujący się na przedniej powierzchni nagłośni), podczas gdy czubek prostego ostrza powinien bezpośrednio unosić nagłośnię. Rękojeść laryngoskopu unosi się do góry i do przodu prostopadle do żuchwy, aż do ukazania się strun głosowych. Należy unikać polegania na zębach. Rurka dotchawicza jest pobierana w prawą rękę i przepuszczana przez otwartą głośnię pod kontrolą wzroku. Mankiet powinien być umieszczony w górnej tchawicy, ale poniżej krtani. Laryngoskop jest usuwany z jamy ustnej, ponownie unikając uszkodzenia zębów. Bezpośrednio po intubacji wykonuje się osłuchiwanie płuc po obu stronach (ponieważ można wprowadzić rurkę do jednego oskrzela) oraz w nadbrzuszu (w celu wykluczenia intubacji przełyku). Jeśli rurka znajduje się w tchawicy, mocuje się ją wstążkami, a mankiet jest napompowany. Mankiet powinien znajdować się powyżej poziomu chrząstki pierścieniowatej, gdyż jego długotrwałe przebywanie w krtani może prowadzić do chrypki w okresie pooperacyjnym. Powikłania: intubacja przełyku, oskrzeli, położenie mankietu w krtani, uszkodzenie zębów, zwichnięcie żuchwy, skurcz krtani, zaburzenia odruchowe (nadciśnienie, tachykardia, podwyższone ciśnienie śródczaszkowe), uraz dróg oddechowych, stany zapalne itp. 4. Nakłucie i cewnikowanie przestrzeni zewnątrzoponowej Wskazania: zespół silnego bólu, interwencje chirurgiczne, zapewnienie analgezji pooperacyjnej. Poziom ustawienia blokady zewnątrzoponowej zależy od tego, który narząd wymaga znieczulenia. Tabela nr 1 przedstawia przykłady „narządów docelowych” do nakłucia zewnątrzoponowego. Tabela 1 Poziomy kręgosłupa i „narządy docelowe”
Oprzyrządowanie: igły do znieczulenia, specjalna igła do nakłuwania przestrzeni zewnątrzoponowej, strzykawka do próbek, cewnik, korek, kulki filtracyjne, serwetki, taśma klejąca i sterylne rękawiczki. Pozycja pacjenta siedzi lub leży na boku. W takim przypadku kolana i podbródek powinny znajdować się jak najbliżej klatki piersiowej. W ten sposób powstaje maksymalne zgięcie kręgosłupa, przy którym zwiększa się kąt między wyrostkami kolczystymi sąsiednich kręgów i ułatwia dostęp do więzadła żółtego. W warunkach aseptycznych i w znieczuleniu miejscowym 0,5% roztworem nowokainy wykonuje się nakłucie przestrzeni nadtwardówkowej. Igła jest wstrzykiwana ściśle prostopadle, ale w przypadku osteochondrozy możliwy jest kąt nachylenia lub podczas nakłucia w okolicy środkowej klatki piersiowej. Gdy igła wejdzie w grubość więzadeł, usuwa się z niej mandrynę i dołącza się strzykawkę z płynem. Dalsze przesuwanie igły odbywa się powoli i płynnie z naciskiem na tłok strzykawki. Ze względu na znaczny opór więzadeł płyn nie może opuścić strzykawki. Strzykawka jest odłączona, a cewnik włożony na 5-7 cm, nie powinno być żadnego oporu. Igła jest usuwana, a przewodnik jest mocowany z tyłu za pomocą taśmy samoprzylepnej, doprowadzając go do przedniej powierzchni klatki piersiowej. Wtyczka z filtrem jest przymocowana do przewodu. Wstrzykuje się środek znieczulający. Następnie określa się poziom znieczulenia skóry. Powikłania: zaburzenia oddechowe i hemodynamiczne, zatrucie, uszkodzenie opony twardej, powikłania neurologiczne, zapalenie okołotwardówkowe. 5. Nakłucie lędźwiowe Wskazania: obecność zespołu oponowego, wysokie ciśnienie śródczaszkowe, diagnostyka różnicowa udaru niedokrwiennego i krwotocznego, urazowe uszkodzenie mózgu, guzy rdzenia kręgowego. Przeciwwskazania: obecność procesu zapalnego lub ropnego w miejscu nakłucia, skaza krwotoczna, guz tylnego dołu czaszki, zwichnięcie tułowia, stan terminalny pacjenta, z niewyraźnymi granicami nerwu wzrokowego. Punkt nakłucia znajduje się między trzecim a czwartym wyrostkiem kolczystym kręgów lędźwiowych. Manipulacja odbywa się w warunkach aseptycznych, w znieczuleniu miejscowym. Igła idzie prostopadle w kierunku pępka. Układanie pacjenta jest takie samo jak przy nakłuciu zewnątrzoponowym. Wraz z przejściem trzech więzadeł (zewnętrznych i wewnętrznych międzykolcowych, żółtych więzadeł) pojawia się uczucie upadku, mandryn jest usuwany z igły i pojawia się płyn mózgowo-rdzeniowy. Po pobraniu płynu mózgowo-rdzeniowego do badania wprowadza się mandrynę i usuwa igłę, nakleja aseptyczną naklejkę. W przeciwieństwie do nakłucia zewnątrzoponowego dochodzi do uszkodzenia opony twardej. Płyn mózgowo-rdzeniowy jest przezroczysty, bezbarwny, ciśnienie 3-4 mm wody. Art., zawartość białka 100 g/l, HC - 200-0,33, pH = 1003-1008, zawartość cukru równa połowie cukru we krwi (normalnie 7,35-7,40 mmol/l), chlorki - 2-3 mmol/l, liczba komórek do 110 limfocytów. Powikłania: zapalenie nadtwardówkowe, zwichnięcie mózgu do otworu wielkiego, zaburzenia neurologiczne. Wykład nr 3. Ostre zaburzenia świadomości Świadomość jest najwyższą formą odbicia rzeczywistości, która jest zbiorem procesów psychicznych, które pozwalają człowiekowi poruszać się w otaczającym go świecie, czasie, własnej osobowości, która zapewnia jego zachowanie. Upośledzenie świadomości to ogólna nazwa zaburzeń integralnej aktywności mózgu, wyrażających się naruszeniem zdolności do odpowiedniego postrzegania, rozumienia i reagowania na otoczenie, poruszania się po nim, zapamiętywania bieżących wydarzeń, nawiązywania kontaktu głosowego i wykonywania arbitralnych środków akty behawioralne. Istnieją różne opcje depresji świadomości (otępienie, otępienie, śpiączka o różnej głębokości), a także ostre splątanie (stan delirium lub encefalopatia metaboliczna). Stopień upośledzonej świadomości waha się od lekkiego splątania do śpiączki i nie ma wyraźnych przejść między tymi stanami. W praktyce stopień upośledzenia świadomości zależy od reakcji pacjenta na bodźce. Otępienie to forma zaburzonej świadomości, charakteryzująca się letargiem, spowolnieniem i trudnościami w przebiegu procesów psychicznych, szybkim wyczerpaniem uwagi, podwyższeniem progu percepcji bodźców zewnętrznych, ale przy zachowaniu ograniczonego kontaktu werbalnego. Ogłupienie polega na naruszeniu uwagi, tj. umiejętności wybierania niezbędnych informacji i koordynowania reakcji w taki sposób, aby nie naruszać logicznej sekwencji myśli i działań. Najczęstszymi przyczynami otępienia są zaburzenia metaboliczne i toksyczne, ale czasami obserwuje się je również przy ogniskowych zmianach kory, zwłaszcza prawego płata ciemieniowego. U takich pacjentów możliwe jest uzyskanie odpowiedzi jednosylabowej lub wykonanie najprostszych instrukcji tylko po uporczywych apelach lub dodatkowej stymulacji. Wraz z dalszym uciskiem świadomości traci się możliwość kontaktu głosowego i rozwija się sopor. Sopor to stan głębokiej depresji świadomości z utratą możliwości kontaktu z pacjentem, ale zachowaniem skoordynowanych reakcji obronnych i otwarciem oczu pacjenta w odpowiedzi na ból, dźwięk lub inne bodźce. Pacjenta nie można w pełni wybudzić nawet przy pomocy bolesnych bodźców, leży z zamkniętymi oczami. Reakcja na instrukcje słowne jest słaba lub całkowicie nieobecna, nie można uzyskać od pacjenta słowa odpowiedzi lub dźwięku. Wraz z dalszym uciskiem świadomości rozwija się śpiączka. Śpiączka to stan nieświadomości charakteryzujący się niewrażliwością na bodźce zewnętrzne. Jest to zagrażający życiu stan depresji funkcji ośrodkowego układu nerwowego i zaburzeń regulacji funkcji życiowych. Śpiączka może być spowodowana wieloma różnymi zaburzeniami metabolicznymi i uszkodzeniami strukturalnymi. Patofizjologia śpiączki Najczęściej śpiączka jest spowodowana: 1) procesy wewnątrzczaszkowe z uszkodzeniem tkanki mózgowej (krwiak, ropień, guz, padaczka); 2) zakaźne zmiany ośrodkowego układu nerwowego (zapalenie opon mózgowych, zapalenie mózgu); 3) toksyczne uszkodzenie mózgu (zatrucie alkoholem, grzybami, narkotykami); 4) niewydolność mózgowego przepływu krwi (konsekwencje asystolii, napadów Morgagniego-Adamsa-Stokesa); 5) przyczyny metaboliczne (zaburzenie równowagi wodno-elektrolitowej, gospodarki węglowodanowej, równowagi kwasowo-zasadowej, niewydolności nerek i wątroby); 6) zaburzenie równowagi temperaturowej (udar cieplny, hipotermia). com klasyfikacja Według etiologii wyróżnia się następującą śpiączkę. 1. Pierwotne lub wewnątrzczaszkowe: urazowe, naczyniowe, zakaźne, nowotwory mózgu, epileptyczne, metaboliczne i niedotlenione. 2. Wtórne lub pozaczaszkowe: ciężkie uszkodzenie mózgu. W zależności od stopnia zaawansowania śpiączki są klasyfikowane w następujący sposób. 1. Umiarkowana śpiączka, gdy pacjent reaguje na bolesne bodźce. W odpowiedzi na nie mogą pojawić się ruchy zgięcia i prostowników. Ale ochronne reakcje motoryczne są nieskoordynowane. Ból pacjenta nie otwiera oczu. Odruchy źreniczne i rogówkowe są zwykle zachowane, odruchy brzuszne są obniżone, a odruchy ścięgniste są zmienne. Zwiększone odruchy automatyzmu jamy ustnej i patologiczne odruchy stóp. 2. Głęboka śpiączka. Charakteryzuje się brakiem reakcji na jakiekolwiek bodźce zewnętrzne, różnymi zmianami napięcia mięśniowego, spadkiem lub brakiem odruchów bez obustronnego rozszerzenia źrenic, zaburzeniami spontanicznego oddychania i czynności sercowo-naczyniowej. 3. Śpiączka terminalna jest określana przez obustronne utrwalone rozszerzenie źrenic, rozlaną atonię mięśni, ciężkie naruszenia funkcji życiowych, zaburzenia rytmu i częstości oddechów, bezdech i ciężki tachykardię; ciśnienie krwi jest krytyczne lub nie jest określone. Badanie pacjenta ze śpiączką Plan badania pacjenta jest następujący. 1. Ocena stanu funkcjonalnego układu oddechowego i sercowo-naczyniowego. 2. Ogólne badania kliniczne z uwzględnieniem danych laboratoryjnych, pozwalające na ocenę patologii pozaczaszkowej. 3. Badanie neurologiczne. Badania laboratoryjne: ogólne kliniczne badanie krwi (objawy infekcji bakteryjnej lub wirusowej); chemia krwi: glukoza, czynniki krzepnięcia (czas krzepnięcia, protrombina, fibrynogen, APTT, antytrombina III, testy parakoagulacyjne, liczba płytek krwi), mocznik, kreatynina, bilirubina, ALT, AST, osmolarność, elektrolity (K, Na, Mg, Ca ); badanie toksykologiczne krwi, moczu, treści żołądkowej. Badania instrumentalne: radiografia czaszki i kręgosłupa szyjnego. Konsultacja neuropatologa (neurochirurga) wyznacza dalszy kierunek poszukiwań diagnostycznych: rezonans komputerowy lub rezonans magnetyczny; EEG; dopplerografia ultradźwiękowa. Nakłucie lędźwiowe z analizą płynu mózgowo-rdzeniowego jest obowiązkowe po: 1) konsultacja okulisty i wykluczenie oznak zwiększonego ciśnienia śródczaszkowego - obrzęk i uniesienie tarczy nerwu wzrokowego; 2) wykluczenie oznak przepukliny mózgu. Wyróżnia się następujące lokalizacje przepukliny mózgu. Przepuklina międzymózgowia, która występuje, gdy uszkodzona jest przyśrodkowa lokalizacja nadnamiotowa i polega na przemieszczeniu międzymózgowia przez wycięcie ścięgna móżdżku. Ten proces wywołuje: 1) oddychanie Cheyne-Stokesa; 2) zwężenie źrenic przy zachowaniu ich reakcji na światło; 3) paraliż wzroku; 4) zmiany stanu psychicznego. Przepuklina przyśrodkowych części płata skroniowego, która występuje, gdy dotknięta jest boczna lokalizacja nadnamiotowa, polega na przemieszczeniu przyśrodkowych części płata skroniowego przez wycięcie czopu móżdżku. Powstały nacisk na struktury śródmózgowia objawia się: 1) upośledzona świadomość; 2) powiększoną, niereaktywną źrenicę po stronie przepukliny, co wiąże się z uciskiem nerwu czaszkowego III; 3) niedowład połowiczy po przeciwnej stronie. Ruchy gałek ocznych nie zawsze są zaburzone. Przepuklina migdałków móżdżku, która jest spowodowana naciskiem przepychającym dolną część móżdżku przez otwór wielki, co prowadzi do ucisku rdzenia przedłużonego. Wywołuje: 1) upośledzona świadomość; 2) naruszenia rytmu oddychania lub bezdechu. Leczenie Leczenie powinno być jak najbardziej agresywne i ukierunkowane przede wszystkim na zapewnienie odpowiedniego dotlenienia i stabilizacji hemodynamiki ośrodkowej. W przypadku podtrzymania oddychania spontanicznego zaleca się wdmuchiwanie nawilżonego tlenu przez maskę lub cewnik nosowy. W przypadku braku oddychania spontanicznego lub w obecności oddychania patologicznego wykonuje się intubację tchawicy i przenosi pacjenta do sztucznej wentylacji płuc. Przy pobudzeniu psychomotorycznym i reakcji na wentylację mechaniczną konieczne jest stosowanie środków uspokajających (benzodiazepiny, butyrofenony). Stabilizacja centralnej hemodynamiki to normalizacja ciśnienia krwi. W stanie nadciśnienia ciśnienie krwi musi zostać obniżone, ale nie więcej niż 10% pierwotnego na godzinę. Dobrym efektem jest zastosowanie nitroprusydku sodu lub siarczanu magnezu. W przypadku niedociśnienia stosuje się dopaminę, dopaminę, dobutreks i leki hormonalne. W przypadku braku danych anamnestycznych i niejasnej diagnozy przeprowadza się terapię ex juvantibus (pozytywna odpowiedź na ekspozycję na lek z jednej strony stanowi klucz do diagnozy, z drugiej pozwala zyskać czas na uniknięcie nieodwracalnych zmian ): 1) tiamina - 100 mg dożylnie, następnie - 100 mg domięśniowo (szczególnie w przypadku alkoholizmu w wywiadzie, przy określaniu wysokich stężeń etanolu we krwi); 2) glukoza - dożylnie 40% roztwór 60 ml (o nieznanym poziomie glukozy w osoczu lub na poziomie poniżej 3 mmol / l); 3) nalokson - 0,4-1,2 mg dożylnie, frakcyjnie, wielokrotnie, zwłaszcza w obecności "objawów opiatowych" (ślady wstrzyknięć dożylnych, wąskie źrenice, zaburzenia ośrodkowego układu oddechowego); 4) anexat (flumazenil) – 0,2 mg przez 30 sekund, w ciągu kolejnej minuty wstrzykiwać kolejne 0,3 mg, w ciągu każdej kolejnej minuty – 0,5 mg do łącznej dawki 3 mg. W przypadku braku efektu można założyć, że jest mało prawdopodobne, aby śpiączka była spowodowana lekami benzodiazepinowymi; 5) w przypadku zatrucia lub przedawkowania znanym lekiem lub substancją należy podać odpowiednie antidotum (jeśli istnieje możliwość leczenia antidotum). Kontrola napadów. Nadchodzące niedotlenienie mózgu może powodować stan padaczkowy. Epizody napadów mogą być także skutkiem toksyczności leków antycholinesterazy. W leczeniu lekiem z wyboru są benzodiazepiny: midazolam (Dormikum) 5 mg dożylnie w dawkach ułamkowych do dawki całkowitej 30 mg g, seduxen (Relanium) w dawkach ułamkowych do 10 mg dożylnie. W przypadku rozwoju stanu padaczkowego po benzodiazepinach konieczne jest podawanie fenytoiny w całkowitej dawce 1-1,5 g z szybkością 50 mg/min. W przypadku oporności na te leki konieczne jest podanie fenobarbitalu (tiopentalu) w łącznej dawce do 1000 mg w powolnej infuzji dożylnej (konieczna jest kontrola oddychania i ciśnienia krwi). W przypadku nawracających napadów konieczne jest znieczulenie ogólne. U chorych, u których w EEG lub tomografii komputerowej występują objawy ogniska padaczkowego (krwotok, nowotwór, duży zawał niedokrwienny, ropień itp.) oraz epizodyczne napady padaczkowe, konieczne jest leczenie podtrzymujące fenytoiną w dawce 300 mg XNUMX raz dziennie doustnie. Utrzymanie normotermii. Konieczna jest kontrola temperatury w odbycie: jej spadek poniżej 34°C rozwija się w przypadku hipotermii, przedawkowania środków nasennych i uspokajających, niedoczynności tarczycy, choroby Wernickego. W takich przypadkach konieczne jest stopniowe ogrzanie pacjenta do temperatury 36°C. Resuscytacji krążeniowo-oddechowej poddawani są pacjenci z hipotermią i brakiem funkcji życiowych, ponieważ niska temperatura zmniejsza zapotrzebowanie serca i mózgu na tlen i przyczynia się do lepszego wyniku działań resuscytacyjnych (z wyjątkiem przypadków, którym towarzyszy hiperkaliemia). Obecność gorączki u pacjentów w śpiączce wymaga aktywnego poszukiwania i leczenia powikłań infekcyjnych. Obecność objawów meningizmu może wskazywać na bakteryjne zapalenie opon mózgowo-rdzeniowych lub krwawienie podpajęczynówkowe (chociaż od początku krwawienia do chemicznego podrażnienia opon mózgowo-rdzeniowych musi upłynąć około 12 godzin). Inną przyczyną gorączki może być ropień wewnątrzczaszkowy lub krwiak podtwardówkowy. W przypadku podejrzenia bakteryjnego zapalenia opon mózgowo-rdzeniowych należy wykonać nakłucie lędźwiowe (badanie płynu mózgowo-rdzeniowego) i tomografię komputerową w celu określenia objawów zwiększonego ciśnienia wewnątrzczaszkowego. Zapobieganie aspiracji treści żołądkowej. Konieczność płukania żołądka w przypadku zatrucia i przedawkowania leków, a co za tym idzie założenie zgłębnika żołądkowego zwiększa ryzyko zarzucania treści żołądkowej (w wyniku rozluźnienia zwieracza żołądkowo-przełykowego). Dlatego przed wprowadzeniem zgłębnika żołądkowego należy wykonać intubację dotchawicy za pomocą mankietu uszczelniającego, który jest najlepszą metodą zabezpieczenia dróg oddechowych. Leczenie urologiczne. Aby kontrolować diurezę, konieczne jest założenie cewnika Foleya, zapewnienie warunków aseptycznych i prowadzenie terapii przeciwdrobnoustrojowej w celu zapobiegania posocznicy układu moczowo-płciowego. Zmniejszone ciśnienie wewnątrzczaszkowe. Wzrost ICP jest pilną sytuacją kliniczną wymagającą podjęcia odpowiednich działań mających na celu jego zmniejszenie, co pozwala uniknąć wtórnego uszkodzenia mózgu na skutek ucisku jego tkanek lub zmniejszenia mózgowego przepływu krwi. Przeprowadzenie powyższych działań diagnostycznych pozwala ustalić przyczyny zwiększonego ICP, a zatem kluczowe środki mają na celu jego eliminację (leczenie operacyjne i zachowawcze). Hiperwentylacja w celu utrzymania poziomu pCO2 25-30 mmHg Sztuka. (poziom poniżej 25 mm Hg może powodować znaczne zmniejszenie przepływu krwi w mózgu, prowadząc do niedokrwienia mózgu). Ograniczenie przyjmowania płynów. Należy wykluczyć roztwory zawierające wolną wodę (5% glukozy). Izotoniczny roztwór NaCl, niezbędny do utrzymania osmolarności krwi, należy podawać w połowie dawki. Wprowadzenie substancji osmotycznie czynnych. Mannitol podaje się w dawce 1-2 g/kg przez 10-20 minut, a następnie w dawce podtrzymującej 0,05-0,3 g/kg co 6 h. Dodatkowo w celu skuteczniejszego obniżenia ICP podaje się furosemid. Ścisła kontrola terapii jest konieczna, aby zapobiec powikłaniom: zmniejszeniu objętości wewnątrznaczyniowej, niedociśnieniu, hipernatremii, hipokalcemii, hipokaliemii, a także zespołowi odpowiedzi i pęknięciu żył korowych w krwiaku podtwardówkowym. Ważnym środkiem zapobiegającym powikłaniom jest utrzymanie skurczowego ciśnienia krwi na poziomie 100-110 mm Hg. Sztuka. Narkotyki również prowadzą do zmniejszenia ICP. Stosowanie środków zwiotczających mięśnie przyczynia się do obniżenia ICP podczas wentylacji mechanicznej (blokada zwiększonego wewnątrz klatki piersiowej ciśnienia żylnego podczas wentylacji mechanicznej), ale są one zalecane tylko na bardzo krótki czas. Stosowanie kortykosteroidów jest skuteczne w przypadkach zwiększonego ciśnienia śródczaszkowego z powodu neoplazji lub ogniskowego niedokrwienia (udaru) mózgu. Nie udowodniono skuteczności kortykosteroidów w leczeniu podwyższonego ciśnienia śródczaszkowego w wyniku urazu i ogólnego niedokrwienia mózgu. Należy pamiętać, że glikokortykosteroidy mogą powodować wzrost poziomu glukozy we krwi, a tym samym nasilać niedokrwienie mózgu. Rodzaje com Śpiączka hipoglikemiczna występuje przy przedawkowaniu insuliny w leczeniu cukrzycy lub przy ograniczeniu spożycia węglowodanów. Rozwój śpiączki poprzedza bulimia, drażliwość, strach. Czasami obserwuje się podwójne widzenie, halucynacje, drgawki toniczne i kloniczne. Podniecenie zostaje zastąpione adynamią i na odwrót. Pacjent szybko traci przytomność i jest pokryty potem. Skóra jest wilgotna i blada, oddech płytki, rytmiczny. Czasami u sportowców i po dużym wysiłku fizycznym obserwuje się samoistną hipoglikemię. Jeśli śpiączka hipoglikemiczna trwa dłużej niż 3 godziny, możliwy jest rozwój dużych organicznych uszkodzeń ośrodkowego układu nerwowego. Ważne jest, aby obniżyć poziom cukru we krwi poniżej 3 mmol. W moczu nie ma cukru ani acetonu. Leczenie. Natychmiast wprowadź 20-40% glukozy w dawce 20-30 ml dożylnie jako bolus. Następnie przeprowadza się kontrolę cukru we krwi i moczu. Śpiączka cukrzycowa lub hiperglikemia, gdy poziom glukozy we krwi gwałtownie wzrasta. Śpiączka poprzedzona jest sennością, pragnieniem, anoreksją, nudnościami, wymiotami, bólem głowy. Hiperglikemia, kwasica metaboliczna są określane w laboratorium, cukier i aceton są obecne w moczu (nie zawsze). Twarz jest blada i przekrwiona, błony śluzowe suche, skóra również sucha, a jej turgor jest zmniejszony. Gałki oczne są zapadnięte, możliwy zapach acetonu z ust. Oddychanie jest rzadkością patologiczną. Zaburzona jest hemodynamika: tachykardia, niedociśnienie tętnicze, stłumione odgłosy serca. Leczenie. Eliminacja hipowolemii za pomocą dożylnego podawania chlorku sodu w objętości 3-5 litrów na dobę. Insulinoterapia polega na wprowadzaniu za pomocą pompy infuzyjnej krótko działającej insuliny 6-10 jm na godzinę. Wraz ze spadkiem stężenia glukozy we krwi do 11-13 mmol / l dawka insuliny zmniejsza się do 4-8 jednostek na godzinę, a infuzja 5% glukozy zaczyna unikać stanu hipoglikemii. Śpiączka tarczycowa występuje rzadko, ale należy o tym pamiętać, jeśli przy ciężkim częstoskurczu nie występują typowe objawy niewydolności hemodynamicznej mięśnia sercowego i występuje niewydolność energetyczno-dynamiczna serca. Obecność brzdąkania, olśnienia i drżenia zwykle również zwraca uwagę na tę możliwość. Obraz kliniczny należy uzupełnić poprzez zbieranie danych anamnestycznych, ponieważ nie można przeprowadzić badań potwierdzających diagnozę (metabolizm podstawowy, radioaktywny jod). Zatrucie alkoholem objawia się zapachem alkoholu z ust, stanem delirium, niepokojem, wymiotami i opuchniętą twarzą. Oddychanie jest powolne, puls przyspieszony, źrenice rozszerzone. U pacjentów z alkoholizmem majaczenie rozwija się 2-3 dni po odstawieniu alkoholu. Stosowanie benzodiazepin zapobiega rozwojowi majaczenia, gdy pojawiają się znaki ostrzegawcze (gorączka, drżenie, tachykardia, nadciśnienie). Wraz z rozwojem delirium lekami z wyboru są: u młodych ludzi diazepam (podawanie dożylne), a u osób starszych i pacjentów z zaburzeniami czynności wątroby lorazepam, ale w razie potrzeby preferowany jest szybki efekt niż diazepam (5 mg co 5 minut do uzyskania efektu). Opisano przypadki konieczności podania 2640 mg diazepamu w leczeniu ciężkiego stanu delirium. Dodatkowo stosuje się blokery i klonidynę. Również w tych warunkach przydatne jest stosowanie leków przeciwpsychotycznych (haloperidol, droperidol). W przypadku śpiączki apopleksji (rozwija się z różnymi procesami śródmózgowymi) wiodącym objawem jest hemiplegia lub paraliż poszczególnych grup mięśni. Paraliż pojawia się, gdy oczy i głowa są zwrócone w kierunku przeciwnym do sparaliżowanego: „pacjent patrzy na zmianę w mózgu”. Usta są przekrzywione na zdrową stronę: „palenie fajki po chorej stronie”. Po stronie hemiplegii uniesiona kończyna szybko i ciężko opada na łóżko, podczas gdy kończyna nie dotknięta chorobą powoli wraca do swojej pierwotnej pozycji. Śpiączka z chorobą Addisona (śpiączka nadnerczy, często rozwijająca się z gruźlicą nadnerczy, urazem, chorobami zakaźnymi) jest rzadka. Wiodącym objawem jest patologicznie niskie, często niemierzalne ciśnienie krwi. Wraz z zapaścią objaw ten jest spowodowany zmianami w metabolizmie węglowodanów (hipoglikemia), zaburzeniami równowagi elektrolitowej i gospodarki wodnej. Nagle pojawia się ostra bladość, zimny pot. Pobudzenie zostaje szybko zastąpione adynamią, po czym pacjent traci przytomność. Pojawia się akrocyjanoza, skóra staje się marmurkowata. Na skórze pleców i kończyn pigmentacja występuje w postaci ciemnych plam i jasnoczerwonej wysypki wybroczynowej. Dźwięki serca są stłumione. Szybko pojawia się odwodnienie i skąpomocz. We krwi kwasica metaboliczna, hipoglikemia i wzrost zalegającego azotu. Leczenie polega na szybkim wprowadzeniu glikokortykosteroidów w dawce 1 mg/kg. Dawkę można zwiększyć 2-3 razy. Podobną dawkę podaje się domięśniowo. Aby zwalczyć odwodnienie, podaje się izotoniczny roztwór chlorku sodu, a następnie glukozę. Wykład nr 4. Resuscytacja krążeniowo-oddechowa Resuscytacja krążeniowo-oddechowa (RKO) to zespół zabiegów chirurgicznych i terapeutycznych wykonywanych przy braku urazów zagrażających życiu, mających na celu przywrócenie i wspomaganie funkcji układu sercowo-oddechowego. Wskazania do resuscytacji krążeniowo-oddechowej: wykonywana u pacjentów z brakiem efektywnego tętna na tętnicach szyjnych lub nitkowatym, słabym tętnem, którzy są nieprzytomni i (lub) przy braku efektywnych ruchów oddechowych. Najczęstsze przypadki pierwotnego zatrzymania krążenia, a także pierwotnej niewydolności oddechowej. Przeciwwskazania: uraz niezgodny z życiem, terminalne stadia nieuleczalnych chorób i śmierć biologiczna. Podstawowe zasady Podstawowe wysiłki w resuscytacji krążeniowo-oddechowej mają na celu: 1) kompresja klatki piersiowej; 2) wdmuchiwanie powietrza do płuc i wentylację; 3) przygotowanie i podawanie leków; 4) instalacja i konserwacja dostępu dożylnego; 5) czynności specjalistyczne (defibrylacja, instalacja rozrusznika, intubacja tchawicy). Do realizacji pełnego zakresu działań potrzebne są więc 4 osoby oraz lider zespołu. Jedna osoba powinna być odpowiedzialna za resuscytację krążeniowo-oddechową. Osoba ta powinna zintegrować wszystkie dostępne informacje i nadać priorytet wpływowi. Musi monitorować monitor EKG, stosowanie leków i upewnić się, że działania innych członków zespołu są korygowane. Powinien zostać usunięty z wykonywania procedur, które umniejszają rolę lidera. Od ponad 40 lat alfabet resuscytacji Safar jest używany do resuscytacji krążeniowo-oddechowej. W tym kompleksie zachowana jest sekwencja działań resuscytatora, zgodnie z ich angielską nazwą są one oznaczone odpowiednimi literami. A - Drogi oddechowe - zapewnienie drożności dróg oddechowych. B - Oddychanie - sztuczna wentylacja płuc (ALV) w przystępny sposób, np. podczas oddychania „usta-usta”. C - Krążenie - zapewniające hemokrążenie - pośredni masaż serca. D - Narkotyki - wprowadzenie narkotyków. E - Elektrokardiografia - rejestracja EKG. F - Fibrylacja - przeprowadzanie w razie potrzeby defibrylacji elektrycznej (kardiowersji). G - Gauging - ocena wyników pierwotnych. H - Hipotermia - chłodzenie głowy. I - Intensywna terapia - intensywna terapia zespołów poresuscytacyjnych. A - Drogi oddechowe - zarządzanie drogami oddechowymi Pacjent kładzie się poziomo na plecach. Głowa jest odrzucona maksymalnie do tyłu, w tym celu lekarz wkłada jedną rękę pod szyję, drugą kładzie na czole pacjenta; oddech testowy jest pobierany z ust do ust. Jeśli pacjent z obniżonym napięciem mięśniowym leży na plecach, jego język może zapadać się, jakby ugniatał gardło. W tym samym czasie nagłośnia opada, dodatkowo blokując drogi oddechowe. Pojawiają się: dźwięczny oddech, a następnie naruszenia rytmu oddechowego aż do całkowitego zatrzymania. Takie zjawiska rozwijają się szczególnie szybko u pacjentów nieprzytomnych. Aby zapobiec i wyeliminować cofanie języka, należy wysunąć żuchwę do przodu i jednocześnie wykonać przeprost w stawie potyliczno-szyjnej. Aby to zrobić, z naciskiem kciuków na brodę dolną szczękę pacjenta przesuwa się w dół, a następnie palcami umieszczonymi w rogach szczęki popychają ją do przodu, uzupełniając tę technikę przeprostem głowy z tyłu (technika potrójnego Safara). Przy prawidłowym i terminowym przeprowadzeniu tych manipulacji drożność dróg oddechowych na poziomie gardła zostaje szybko przywrócona. Ciała obce (skrzepy krwi, śluz, protezy itp.) mogą być przyczyną niedrożności dróg oddechowych. Są szybko usuwane za pomocą improwizowanych materiałów (serwetka, chusteczka). Głowa pacjenta powinna być zwrócona na bok ze względu na niebezpieczeństwo aspiracji. Przywrócenie drożności górnych dróg oddechowych ułatwia zastosowanie różnych kanałów powietrznych. Najbardziej odpowiednie jest zastosowanie kanału w kształcie litery S. W celu jego wprowadzenia otwiera się usta pacjenta skrzyżowanymi palcami II i I, a rurkę przesuwa się do nasady języka tak, aby jej otwór „przesuwał się” wzdłuż podniebienia. Należy zadbać o to, aby kanał powietrzny nie poruszał się podczas transportu. Jeśli wszystkie opisane procedury nie są skuteczne, możemy założyć obecność obturacji dróg oddechowych w leżących poniżej odcinkach. W takich przypadkach wymagana jest bezpośrednia laryngoskopia i aktywna aspiracja patologicznej wydzieliny, a następnie intubacja tchawicy przez 10-15 sekund. Wskazane jest wykonanie konikotomii i tracheostomii. B - Oddychanie - sztuczna wentylacja płuc (ALV) w przystępny sposób Najprostszą i najskuteczniejszą metodą sztucznego oddychania podczas resuscytacji jest metoda „usta-usta”, w której wydychane powietrze resuscytatora jest wdmuchiwane do płuc ofiary pod ciśnieniem. Odrzuciwszy do tyłu głowę ofiary, jedną ręką szczypią go w nozdrza, drugą wkładają pod szyję, biorą głęboki oddech, mocno przyciskając usta do ust ofiary (u dzieci do ust i do ust). nosem) i wdmuchnąć powietrze do płuc ofiary, obserwując unoszenie się klatki piersiowej w czasie wdechu. Jak tylko klatka piersiowa unosi się, wstrzykiwanie powietrza zostaje zatrzymane, przesuwają twarz na bok, ponownie biorą głęboki oddech, a pacjent w tym czasie ma bierny wydech. Po 2-3 napełnieniach płuc określa się obecność tętna na tętnicy szyjnej, jeśli nie zostanie wykryty, wówczas przystępują do sztucznego przywrócenia krążenia krwi. Wentylację ręczną stosuje się za pomocą samorozprężnego worka typu Ambu. Podczas korzystania z respiratora częstość oddechów wynosi 12-15 na minutę, objętość wdechowa wynosi 0,5-1,0 litra. W szpitalu wykonuje się intubację tchawicy, a pacjenta przenosi się do respiratora. C-Circulation - zapewnienie hemocyrkulacji - pośredni masaż serca Masaż przy zamkniętym sercu to najprostszy i najskuteczniejszy sposób awaryjnego wspomagania krążenia. Zamknięty masaż serca należy rozpocząć natychmiast po rozpoznaniu ostrego zatrzymania krążenia, nie wyjaśniając jego przyczyn i mechanizmów. W przypadku nieskutecznych skurczów serca nie należy czekać na całkowite zatrzymanie akcji serca lub samodzielne przywrócenie prawidłowej czynności serca. Podstawowe zasady masażu zamkniętego serca. 1. Pacjent powinien znajdować się w pozycji poziomej na solidnym podłożu (podłoga lub niska kanapa), aby zapobiec możliwości przemieszczenia się jego ciała pod wpływem wzmocnienia masujących rąk. 2. Strefa przyłożenia siły rąk resuscytatora znajduje się w dolnej jednej trzeciej mostka, ściśle wzdłuż linii środkowej; resuscytator może znajdować się po obu stronach pacjenta. 3. Do masażu jedną dłoń kładzie się na drugiej i naciska się na mostek w obszarze położonym 3-4 poprzeczne palce powyżej miejsca przyczepienia do mostka wyrostka mieczykowatego; ręce masażera, wyprostowane w stawach łokciowych, są ustawione tak, że tylko nadgarstek wytwarza ucisk. 4. Kompresja klatki piersiowej poszkodowanego wykonywana jest z powodu grawitacji tułowia lekarza. Przemieszczenie mostka w kierunku kręgosłupa (tj. głębokość ugięcia klatki piersiowej) powinno wynosić 4-6 cm. 5. Czas trwania jednego uciśnięcia klatki piersiowej wynosi 0,5 s, odstęp między poszczególnymi uciśnięciami wynosi 0,5-1 s. Tempo masażu - 60 ruchów masujących na minutę. W odstępach ręce nie są zdejmowane z mostka, palce pozostają uniesione, ramiona są całkowicie wyprostowane w stawach łokciowych. Gdy resuscytację prowadzi jedna osoba, po dwóch szybkich wstrzyknięciach powietrza do płuc pacjenta wykonuje się 15 uciśnięć klatki piersiowej, czyli stosunek „wentylacja:masaż” wynosi 2:15. stosunek ten wynosi 2:1, co oznacza 5 uciśnięć klatki piersiowej na oddech. Warunkiem wstępnym masażu serca jest stałe monitorowanie jego skuteczności. Kryteria skuteczności masażu należy rozpatrywać w następujący sposób. 1. Zmiana koloru skóry: staje się mniej blada, szara, sinicza. 2. Zwężenie źrenic, jeśli były rozszerzone, z pojawieniem się reakcji na światło. 3. Pojawienie się impulsu tętna na tętnicach szyjnych i udowych, a czasem na tętnicy promieniowej. 4. Oznaczanie ciśnienia krwi na poziomie 60-70 mm Hg. Sztuka. mierzona na ramieniu. 5. Czasami pojawienie się niezależnych ruchów oddechowych. Jeśli występują oznaki przywrócenia krążenia, ale przy braku tendencji do zachowania samodzielnej czynności serca, masaż serca wykonuje się albo do osiągnięcia pożądanego efektu (przywrócenie efektywnego przepływu krwi), albo do trwałego zaniku oznak życia wraz z rozwojem objawów śmierci mózgu. W przypadku braku oznak przywrócenia nawet zmniejszonego przepływu krwi, pomimo 25-30 minutowego masażu serca, należy uznać, że pacjent umiera i można wstrzymać zabiegi resuscytacyjne. D - Narkotyki - podawanie leków W przypadku ostrego ustania krążenia krwi wprowadzenie środków stymulujących czynność serca należy rozpocząć tak szybko, jak to możliwe, w razie potrzeby powtórzyć podczas resuscytacji. Po rozpoczęciu masażu serca należy jak najszybciej podać 0,5-1 ml adrenaliny (dożylnie lub dotchawiczo). Jego wielokrotne wprowadzenie jest możliwe po 2-5 minutach (łącznie do 5-6 ml). Przy asystolii adrenalina tonizuje mięsień sercowy i pomaga „uruchomić” serce, przy migotaniu komór przyczynia się do przejścia z migotania małych fal w duże, co znacznie ułatwia defibrylację. Adrenalina ułatwia wieńcowy przepływ krwi i zwiększa kurczliwość mięśnia sercowego. Zamiast adrenaliny można zastosować izodrynę, która jest 3 razy skuteczniejsza od adrenaliny pod względem skuteczności działania na mięsień sercowy. Dawka początkowa wynosi 1-2 ml dożylnie, a kolejne 1-2 ml w 250 ml 5% roztworu glukozy. W warunkach upośledzenia krążenia krwi kwasica metaboliczna stopniowo wzrasta, dlatego natychmiast po wlewie adrenaliny podaje się dożylnie 4-5% roztwór wodorowęglanu sodu z szybkością 3 ml / kg masy ciała pacjenta. W procesie umierania ton przywspółczulnego układu nerwowego znacznie wzrasta, mózg jest wyczerpany, dlatego stosuje się M-cholinolityki. W asystolii i bradykardii atropinę podaje się dożylnie w 0,1% roztworze - 0,5-1 ml, do maksymalnej dawki 3-4 ml. Aby zwiększyć napięcie mięśnia sercowego i zmniejszyć efekt hiperkaliemii, zaleca się dożylne podanie 5 ml 10% roztworu chlorku wapnia. Adrenalina, atropina i chlorek wapnia mogą być podawane razem w tej samej strzykawce. W przypadku ciężkiej tachykardii, a zwłaszcza z rozwojem migotania, wskazane jest stosowanie lidokainy w dawce 60-80 mg, ale ponieważ jest ona krótkodziałająca, podaje się ją w infuzji z szybkością 2 mg / min. Wskazane jest również stosowanie glikokortykoidów, które poprzez zwiększenie wrażliwości adrenoreaktywnych struktur mięśnia sercowego na katecholaminy oraz normalizację przepuszczalności błon komórkowych przyczyniają się do przywrócenia prawidłowej czynności serca. E - Elektrokardiografia - Zapis EKG Za pomocą badania EKG określa się charakter naruszenia czynności serca. Najczęściej może to być asystolia - całkowite ustanie skurczów serca, migotanie - chaotyczny nieskoordynowany skurcz włókien mięśnia sercowego z częstotliwością 400-500 uderzeń / min, w którym pojemność minutowa serca praktycznie się zatrzymuje. Początkowo obserwuje się migotanie dużych fal, które w ciągu 1-2 minut przechodzi w migotanie małych fal, a następnie asystolię. Obecność jakiegokolwiek rytmu w EKG jest lepsza niż całkowity brak aktywności elektrycznej mięśnia sercowego. Dlatego kluczowym zadaniem RKO jest pobudzenie aktywności elektrycznej mięśnia sercowego, a następnie przekształcenie jej w efektywny (obecność pulsu) rytm. Obecność asystolii służy jako marker ciężkiego zaburzenia perfuzji mięśnia sercowego i jest złym prognostykiem przywracania rytmu serca. Ważne jest jednak rozróżnienie między migotaniem komór mikrofalowych o niskiej amplitudzie a asystolią, co najlepiej przeprowadzać w standardowych odprowadzeniach EKG 2-3. Adrenalina (1 mg dożylnie) i atropina (1 mg zwiększona do 2-4 mg) są najskuteczniejsze w przywracaniu aktywności elektrycznej. W przypadkach opornych skuteczna jest korekta poziomu potasu i wapnia. Migotanie komór (VF) U pacjentów bez tętna należy wykonać natychmiastową ślepą terapię elektropulsową (przed rozpoznaniem przyczyny zatrzymania krążenia w EKG), ponieważ VF jest najczęstszą przyczyną nagłej śmierci, a o powodzeniu defibrylacji w dużej mierze decyduje czas jej wykonania. Należy zauważyć, że defibrylacja „ślepa” nie zaszkodzi pacjentom z asystolią i bradykardią i jest zwykle skuteczna u pacjentów z tachykardią i VF. Należy pamiętać, że zasada „ślepej” kardiowersji nie jest akceptowana u dzieci, ponieważ znacznie częściej niż migotanie przedsionków występuje zatrzymanie oddechu jako przyczyna śmiertelnej choroby. Powodzenie defibrylacji zależy od amplitudy VF, która z kolei jest odwrotnie skorelowana z czasem trwania epizodu VF. Jeśli dwie początkowe próby kardiowersji są nieskuteczne, w takim przypadku konieczne jest podanie adrenaliny w celu zwiększenia amplitudy fal migotania i zwiększenia napięcia naczyniowego (w przypadku przywrócenia rytmu serca pozwala to na zwiększenie perfuzji serca i mózgu). Z drugiej strony konieczne jest stosowanie optymalnych dawek adrenaliny, aby nie zwiększać zapotrzebowania mięśnia sercowego na tlen. F - Fibrylacja - wykonanie defibrylacji elektrycznej w razie potrzeby (kardiowersji) Migotanie serca można wyeliminować za pomocą defibrylacji elektrycznej. Konieczne jest ścisłe przyłożenie elektrod do klatki piersiowej (w pozycji przednio-bocznej jedna elektroda znajduje się w okolicy wierzchołka serca, druga w okolicy podobojczykowej po prawej stronie mostka), co zwiększa siłę nacisku rozładowanie i, odpowiednio, skuteczność defibrylacji. U wielu pacjentów bardziej skuteczne jest przednio-tylne (wierzchołek serca - przestrzeń międzyłopatkowa) elektrod. Nie nakładaj elektrod na nakładki monitora EKG. Należy zauważyć, że defibrylacja elektryczna jest skuteczna tylko wtedy, gdy w EKG rejestrowane są oscylacje wielkofalowe o amplitudzie od 0,5 do 1 mV lub większej. Ten rodzaj migotania mięśnia sercowego wskazuje na bezpieczeństwo jego zasobów energetycznych i możliwość przywrócenia odpowiedniej czynności serca. Jeśli oscylacje są niskie, arytmiczne i polimorficzne, co obserwuje się w ciężkim niedotlenieniu mięśnia sercowego, wówczas możliwość przywrócenia czynności serca po defibrylacji jest minimalna. W tym przypadku za pomocą masażu serca, wentylacji mechanicznej, dożylnego podawania adrenaliny, atropiny, chlorku wapnia konieczne jest osiągnięcie przejścia migotania na fale wielkofalowe, a dopiero po tym należy wykonać defibrylację. Pierwsza próba defibrylacji wykonywana jest przy wyładowaniu 200 J, przy kolejnych próbach ładunek wzrasta do 360 J. Elektrody należy zwilżyć i mocno docisnąć do powierzchni klatki piersiowej. Do najczęstszych błędów podczas defibrylacji, które powodują nieskuteczność tej ostatniej, należą: 1. Długie przerwy w masażu serca lub całkowity brak resuscytacji podczas przygotowania defibrylatora do wyładowania. 2. Luźny docisk lub niedostateczne zwilżenie elektrod. 3. Zastosowanie wyładowania na tle migotania niskich fal bez podejmowania działań zwiększających zasoby energetyczne mięśnia sercowego. 4. Zastosowanie wyładowania o niskim lub zbyt wysokim napięciu. Należy zauważyć, że defibrylacja elektryczna serca jest skuteczną metodą korygowania takich zaburzeń rytmu serca jak napadowy częstoskurcz komorowy, trzepotanie przedsionków, częstoskurcz węzłowy i nadkomorowy, migotanie przedsionków. Wskazaniem do defibrylacji elektrycznej na etapie przedszpitalnym jest najczęściej napadowy częstoskurcz komorowy. Cechą defibrylacji w tych warunkach jest obecność świadomości pacjenta i konieczność wyeliminowania reakcji na ból podczas stosowania wyładowania elektrycznego. G - Skrajnia - ocena wyników pierwotnych Pierwotna ocena wyników jest przeprowadzana nie tylko w celu ustalenia stanu układu krążenia i oddechowego, ale także w celu nakreślenia taktyki dalszych działań terapeutycznych. Po zakończeniu procesu resuscytacji, w którym nastąpiło przywrócenie czynności serca, resuscytator musi wykonać szereg końcowych czynności: 1) ocenić stan dróg oddechowych (symetria oddychania, z kontynuacją wymuszonego oddychania, adekwatność wentylacji); 2) sprawdzić pulsację w tętnicy centralnej i obwodowej; 3) ocenić kolor skóry; 4) określić poziom ciśnienia krwi; 5) zmierzyć objętość krwi krążącej (zmierzyć CVP, ocenić stan żył szyjnych); 6) sprawdzić prawidłowe położenie cewników w żyłach centralnych; 7) w przypadku ustąpienia migotania serca, które było przyczyną nagłej śmierci, zapewnić kontynuację wlewu jakiegokolwiek leku przeciwfibrylarnego; 8) przeprowadzić korektę terapii, jeżeli została przeprowadzona pacjentowi przed epizodem nagłej śmierci. H - Hipotermia - chłodzenie głowy W przypadku hipotermii krytyczny czas zatrzymania krążenia może znacznie się wydłużyć. Aby zapobiec rozwojowi encefalopatii po niedotlenieniu, należy podjąć działania w celu zmniejszenia intensywności procesów metabolicznych w mózgu, a także leków przeciw niedotlenieniu i przeciwutleniaczy. Główne działania 1. Hipotermia czaszkowo-mózgowa – owijanie głowy i szyi okładami z lodu, śniegiem, zimną wodą. 2. Pozajelitowe podawanie leków przeciw niedotlenieniu (tlenomaślan sodu, mafuzol, małe dawki środków uspokajających), a także poprawiające właściwości reologiczne krwi (reopolyglucyna, hemodez, heparyna, trental). 3. Wprowadzenie antagonistów wapnia (nimoton, lidoflazin itp.). 4. Wprowadzenie antyoksydantów (mafusol, unitiol, witamina C, katalaza itp.). I - Intensywna opieka - prowadzenie intensywnej terapii zespołów poresuscytacyjnych Chociaż szybka pozytywna odpowiedź na RKO zwiększa szanse na pomyślne rokowanie u pacjentów, możliwy jest późniejszy rozwój sepsy, ostrej niewydolności płuc i zapalenia płuc, co w naturalny sposób pogarsza rokowanie. Długotrwałe przeżycie pacjentów z wcześniejszymi chorobami ważnych narządów po RKO nie jest typowe, ponieważ w tym okresie ich zmiany chorobowe pogłębiają się, a ośrodki nerwowe zapewniające autonomiczną kontrolę i utrzymanie odruchów ochronnych ulegają uszkodzeniu. Również przy intensywnej kompresji klatki piersiowej odnotowuje się pęknięcia wątroby, aorty, odmy opłucnowej, złamania żeber i mostka. Częstymi powikłaniami są zachłystowe zapalenie płuc, drgawki (z powodu niedokrwienia mózgu) i zatrucie lidokainą. U wielu pacjentów dochodzi do krwawienia z wrzodów stresowych żołądka i dwunastnicy. Po RKO następuje znaczny wzrost poziomu enzymów wątrobowych (i/lub mięśni szkieletowych), chociaż rozwój martwicy wątroby i niewydolność jej funkcji są rzadkie. W schematach defibrylacji wysokoenergetycznej następuje znaczny wzrost poziomu fosfokinazy kreatynowej, ale wzrost frakcji MB występuje tylko przy powtarzających się wyładowaniach wysokoenergetycznych. 1. Korekta CBS i równowagi wodno-elektrolitowej. Często po RKO rozwija się zasadowica metaboliczna, hipokaliemia, hipochloremia i inne zaburzenia elektrolitowe. Następuje zmiana pH do środowiska kwaśnego lub zasadowego. Kluczem do korekcji pH jest odpowiednia wentylacja. Stosowanie wodorowęglanu powinno odbywać się pod kontrolą składu gazu we krwi. Z reguły nie ma potrzeby wprowadzania NSO3 z szybkim przywróceniem krążenia krwi i oddychania. Przy sprawnym sercu poziom pH ~7,15 jest odpowiedni dla funkcjonowania układu sercowo-naczyniowego. Powszechnie zalecana dawka wodorowęglanu (1 mg/kg) może powodować działania niepożądane, w tym: 1) zasadowica arytmogenna; 2) zwiększona produkcja CO2; 3) hiperosmolarność; 4) hipokaliemia; 5) paradoksalna kwasica wewnątrzkomórkowa ośrodkowego układu nerwowego; 6) przesunięcie w lewo krzywej dysocjacji hemoglobiny, ograniczające dostarczanie O . do tkanek2. Dlatego wyznaczenie tego leku powinno odbywać się ściśle według wskazań. Aby wyeliminować hipokaliemię, wykonuje się dożylny wlew chlorku potasu w dawce 2 mmol/kg na dobę. 2. Normalizacja systemu obrony antyoksydacyjnej. Intensywna terapia obejmuje kompleks leków przeciwutleniających o wielokierunkowym działaniu - mafusol, unitiol, witamina C, multibiont, tokoferol, probucol itp. 3. Stosowanie antyoksydantów przyczynia się do zmniejszenia intensywności procesów metabolicznych, a co za tym idzie zmniejszenia zapotrzebowania na tlen i energię, a także maksymalnego wykorzystania zmniejszonej ilości tlenu dostępnego podczas hipoksji. Osiąga się to poprzez stosowanie leków o działaniu neurowegetatywnym i przeciw niedotlenieniu (seduxen, droperydol, blokery zwojów, meksamina, hydroksymaślan sodu, cytochrom, gutimina itp.). 4. Zwiększenie zasobów energetycznych zapewnia dożylne podawanie stężonych roztworów glukozy z insuliną i głównymi koenzymami zaangażowanymi w wykorzystanie energii (witamina B6, kokarboksylaza, ATP, ryboksyna itp.). 5. Stymulacja syntezy białek i kwasów nukleinowych - substratów absolutnie niezbędnych do prawidłowego funkcjonowania komórek, syntezy enzymów, immunoglobulin i innych, odbywa się przy użyciu hormonów anabolicznych (retabolil, nerabolil, insulina, retinol ), kwas foliowy, a także wprowadzenie roztworów aminokwasów. 6. Aktywacja metabolizmu tlenowego osiągana jest poprzez wprowadzenie odpowiedniej ilości substratów utleniania (glukozy), a także zastosowanie hiperbolicznego natleniania (HBO) - ta metoda zapewnia dostarczenie wymaganej ilości tlenu nawet w warunkach ostrych naruszeń jego dostarczania . 7. Usprawnienie procesów redoks (kwas bursztynowy, ryboksyna, tokoferol itp.). 8. Aktywna terapia detoksykacyjna przyczynia się do normalizacji procesów metabolicznych. W tym celu stosuje się różne metody terapii infuzyjnej (żelatynol, albumina, osocze), wymuszoną diurezę itp. W ciężkich przypadkach stosuje się pozaustrojowe metody detoksykacji (hemosorpcja, hemodializa, plazmafereza). 9. Eliminacja naruszeń procesów mikrokrążenia. W tym celu wykonuje się terapię heparyną. Nie ma jednej wytycznej dla wszystkich sytuacji klinicznych. Podczas trwającej resuscytacji krążeniowo-oddechowej objawy neurologiczne nie mogą służyć jako markery wyniku, a zatem nie można nimi kierować po zatrzymaniu resuscytacji krążeniowo-oddechowej. Resuscytacja rzadko jest skuteczna, jeśli do przywrócenia skoordynowanego rytmu serca potrzeba więcej niż 20 minut. Wiele badań wykazało, że brak odpowiedzi w ciągu 30 minut na pełną resuscytację krążeniowo-oddechową, z rzadkimi wyjątkami, prowadzi do zgonu. Najlepsze rezultaty osiąga się w przypadku natychmiastowej skutecznej kardiowersji. Przedłużona resuscytacja z dobrym wynikiem neurologicznym jest możliwa przy zapewnieniu hipotermii i głębokiej farmakologicznej depresji ośrodkowego układu nerwowego (na przykład barbiturany). Metody określania braku żywotności mózgu: 1) angiografia naczyń mózgowych (brak przepływu krwi); 2) EEG (linia prosta przez co najmniej 24 godziny); 3) tomografia komputerowa. Kryteria zakończenia RKO: 1) jeśli w ciągu 30 minut wszystkie prawidłowo wykonane zabiegi resuscytacyjne nie przyniosą żadnego efektu - nie pojawia się spontaniczny oddech, krążenie krwi nie zostaje przywrócone, źrenice pozostają rozszerzone i nie reagują na światło; 2) jeśli w ciągu 30 minut dojdzie do powtórnych zatrzymań krążenia, które nie nadają się do leczenia, a jednocześnie nie ma innych oznak skutecznej resuscytacji; 3) jeżeli w trakcie resuscytacji stwierdzono, że pacjent w ogóle nie był pokazywany; 4) jeśli w ciągu 45-60 minut, pomimo częściowego przywrócenia oddychania, ofiara nie ma tętna i nie ma oznak przywrócenia funkcji mózgu. Wykład nr 5. Stany awaryjne w pulmonologii Ostra niewydolność oddechowa to stan patologiczny organizmu, w którym funkcja zewnętrznego aparatu oddechowego jest niewystarczająca, aby zapewnić organizmowi tlen i odpowiednie usuwanie dwutlenku węgla. Normalna objętość oddechowa (TO) wynosi 500 ml (wentylacja pęcherzykowa - 350 ml, martwa przestrzeń 150 ml). Minutowa objętość wentylacji (MOV) - 6-8 l. Zużycie tlenu - 300 ml/min. W wydychanym powietrzu tlen wynosi 16%, w wdychanym - 21%. Tlen we wdychanej mieszaninie powinien wynosić co najmniej 20%. Przyczyny ostrej niewydolności oddechowej: naruszenie centralnej regulacji oddychania lub niedopasowanie między wentylacją a przepływem krwi na poziomie respironów - końcowych jednostek strukturalnych i funkcjonalnych płuc. Przedawkowanie substancji odurzających (wdychanie), narkotyczne leki przeciwbólowe, ostry obrzęk mózgu, udar naczyniowo-mózgowy, guzy mózgu, zmniejszenie światła dróg oddechowych lub całkowita niedrożność, cofnięcie języka, duża ilość plwociny, szczególnie u pacjentów z ropnymi chorobami płuc (ropień, obustronne rozstrzenie oskrzeli), krwotok płucny, wymioty i aspiracje, skurcz krtani i skurcz oskrzeli. Kiedy język się cofa, należy umieścić kanał powietrzny lub najbardziej niezawodną metodą jest intubacja i sztuczna wentylacja. Wraz z nagromadzeniem plwociny konieczne jest zmuszenie pacjenta do jej odkrztuszenia. Jeśli pacjent jest nieprzytomny, układ oddechowy jest odkażony. U ciężkich pacjentów wykonuje się znieczulenie i aktywną sanitację. Wykonuje się cewnikowanie tchawicy, drzewa oskrzelowego i usuwanie zawartości. 1. Skurcz krtani Skurcz krtani to zamknięcie prawdziwych i fałszywych strun głosowych. W obu przypadkach koniecznie stosuje się środki kontrolne (eufillin). Jeśli to nie pomaga, należy wprowadzić krótko działające środki zwiotczające mięśnie, zaintubować i przenieść pacjenta na wentylację mechaniczną. Środki zwiotczające mięśnie powodują niewydolność oddechową w okresie pooperacyjnym, jeśli nie zostanie wykonana wystarczająca dekuraryzacja. Jest zwykle wytwarzany przez leki antycholinesterazowe (prozerin). Do czasu ekstubacji należy upewnić się, że siła i napięcie mięśniowe powróciły (poproś o podniesienie ręki, ściśnięcie ręki, podniesienie głowy). Przy wielu złamaniach żeber część klatki piersiowej zapada się podczas wdechu, rozwija się tak zwany oddech paradoksalny, dlatego konieczne jest przywrócenie klatki piersiowej. U tego pacjenta konieczna jest intubacja, po wprowadzeniu środków zwiotczających, z dalszym przejściem na wentylację mechaniczną (do przywrócenia integralności klatki piersiowej). Do zmniejszenia czynności miąższu płucnego prowadzą: niedodma, zapaść płuca, zapalenie płuc, następstwa operacji, odma płucna, hemoroidalna, ropotokowa. Różnice między niedodmą a zapaścią: niedodma to przeszkoda w stanie wyprostowanym. Ten stan charakteryzuje się obecnością niewentylowanego płuca, przez które przepływa połowa krwi krążącej, ta ostatnia nie jest natleniona. W rezultacie rozwija się ostra niewydolność oddechowa. Kiedy płuco zapada się, jest ono ściskane przez powietrze lub płyn w jamie opłucnej. W tym samym czasie krążenie krwi w ściśniętym płucu gwałtownie spada, a krążenie krwi w zdrowym płucu wzrasta. Dlatego zapaść nie jest tak groźnym powikłaniem w zakresie rozwoju ostrej niewydolności oddechowej jak niedodma. Przed zabiegiem należy ocenić funkcję nienaruszonego płuca (oddzielna spirografia). Zgodnie z etapem rozwoju ostrą niewydolność oddechową dzieli się na: 1) dysfunkcja; 2) niewydolność; 3) brak funkcji protetycznej. Zgodnie z tempem rozwoju ostrą niewydolność oddechową dzieli się na: 1) błyskawicznie (rozwija się w ciągu minuty); 2) ostry (rozwija się w ciągu kilku godzin); 3) podostry (rozwija się w ciągu kilku dni); 4) przewlekły (trwa latami). Główne elementy intensywnej terapii w ostrej niewydolności oddechowej: tlenoterapia, drenaż pacjenta, fibrobronchoskopia, tracheostomia, intubacja i wentylacja mechaniczna, rozszerzenie oskrzeli, terapia hormonalna, HBO. 2. Zator płucny Zatorowość płucna (ZP) to zablokowanie głównego lub środkowego tułowia, małych pni naczyniowych tętnicy płucnej, prowadzące do wzrostu ciśnienia w krążeniu płucnym, niewydolności prawej komory. Czynniki predysponujące Choroby układu sercowo-naczyniowego - miażdżyca, choroba reumatyczna serca, malformacje reumatyczne, septyczne zapalenie wsierdzia. Choroby żył kończyn dolnych, patologia narządów i naczyń miednicy małej. Szczególnej uwagi wymaga pooperacyjny PE. Najczęściej zator rozwija się podczas operacji: naczyń kończyn dolnych, pęcherza moczowego, żeńskich narządów płciowych, gruczołu krokowego, kości miednicy i stawu biodrowego. Istotne są zmiany w układzie hemostazy, samoistna fibrynoliza, retrakcja i organizacja zakrzepów żylnych. W największym stopniu zagrożeni są również pacjenci z chorobami onkologicznymi, otyłością, niewydolnością krążenia, którzy z różnych powodów zmuszeni są do długiego leżenia w łóżku. Kliniczna klasyfikacja PE Forma: ciężka, średnia i lekka. Downstream: piorunujący, ostry, nawracający. W zależności od stopnia uszkodzenia tętnicy płucnej: pień lub główne gałęzie, gałęzie płatowe (odcinkowe), małe gałęzie. Klinika i diagnostyka Przebieg kliniczny PE jest dość zmienny. Najczęstsze objawy to nagły początek duszności (RR waha się od 30 do ponad 50 na minutę), przyspieszony oddech, bladość, częściej sinica, obrzęk żył szyjnych, tachykardia, niedociśnienie tętnicze (do wstrząsu), zamostkowa ból, kaszel i krwioplucie. Osłuchiwanie często warunkuje wzmocnienie tonu II nad tętnicą płucną. Objawy rentgenowskie - wzrost wielkości proksymalnej tętnicy płucnej, wyczerpanie wzoru obwodowego, a także podniesienie kopuły przepony. EKG może ujawnić przeciążenie prawych oddziałów (cor pulmonale): 1) pojawienie się fal Q z jednoczesnym wzrostem amplitudy fal R i S (zespół QS); 2) obrót serca wokół osi podłużnej z prawą komorą do przodu (przesunięcie strefy przejściowej do lewych odprowadzeń klatki piersiowej); 3) uniesienie odcinka ST z ujemnym załamkiem T w odprowadzeniach III, aVF, V1-V3; 4) pojawienie się lub zwiększenie stopnia blokady prawej nogi wiązki Jego; 5) wysoki spiczasty „płucny” ząb P z odchyleniem jego osi elektrycznej w prawo; 6) częstoskurcz zatokowy lub tachysystoliczna postać migotania przedsionków. Echokardiografia pozwala na wykrycie ostrego serca płucnego, określenie stopnia zaawansowania nadciśnienia w krążeniu płucnym, ocenę stanu strukturalnego i funkcjonalnego prawej komory, wykrycie zatorowości w jamach serca i głównych tętnicach płucnych, uwidocznienie otwartego otworu owalnego, który może nasilenia zaburzeń hemodynamicznych i być przyczyną zatorowości paradoksalnej. Jednak ujemny wynik badania echokardiograficznego w żadnym wypadku nie wyklucza rozpoznania zatorowości płucnej. Najbardziej informacyjną metodą diagnostyczną jest angiografia tętnic płucnych. W celach profilaktycznych w okresie pooperacyjnym stosuje się antykoagulanty. Dawka heparyny wynosi 10 000 IU na dobę (2 IU 500 razy). W przypadku przeciwwskazań leki przeciwzakrzepowe nie są przepisywane. Przeciwwskazania obejmują: poważne uszkodzenie mózgu; onkopatologia z możliwością krwawienia; małopłytkowość; gruźlica płuc; ciężkie przewlekłe choroby miąższu wątroby i nerek z niewydolnością czynnościową. Leczenie Terapia przeciwzakrzepowa. Leki przeciwzakrzepowe mogą zapobiegać wtórnej zakrzepicy w łożysku naczyń płucnych i progresji zakrzepicy żylnej. Wskazane jest szerokie stosowanie heparyn drobnocząsteczkowych (dalteparyna, eioksaparyna, froksyparyna), które w porównaniu z konwencjonalną heparyną niefrakcjonowaną rzadko powodują powikłania krwotoczne, mają mniejszy wpływ na czynność płytek, mają dłuższy czas działania i wysoką biodostępność. terapia trombolityczna. W masywnym ZTP terapia trombolityczna jest wskazana i uzasadniona w przypadkach, gdy objętość zmiany jest stosunkowo niewielka, ale wyraźne nadciśnienie płucne. Najczęściej streptokinazę stosuje się w dawce 100 000 jednostek na godzinę, należy jednak pamiętać o ciężkich reakcjach alergicznych. Czas trwania trombolizy wynosi zwykle 1-2 dni. Urokinaza i alteplaza są pozbawione właściwości antygenowych, ale mają wysoką odporność. Chirurgia. Embolektomia jest wskazana u pacjentów z chorobą zakrzepowo-zatorową pnia płucnego lub obu jego głównych gałęzi z bardzo ciężkim stopniem upośledzenia perfuzji płuc, któremu towarzyszą wyraźne zaburzenia hemodynamiczne. Wszelkie manipulacje w celu usunięcia zatorów po zaciśnięciu krzyża żyły głównej powinny trwać nie dłużej niż 3 minuty, ponieważ czas ten jest krytyczny dla pacjentów operowanych w warunkach ciężkiej początkowej hipoksji. Optymalne jest wykonanie embolektomii z pomostem krążeniowo-oddechowym z dostępem przezmostkowym. 3. Astma oskrzelowa Astma oskrzelowa to choroba polegająca na przewlekłym zapaleniu dróg oddechowych z komponentem autoimmunologicznym, któremu towarzyszy zmiana wrażliwości i reaktywności oskrzeli, objawiająca się atakiem lub stanem uduszenia, z ciągłymi objawami dyskomfortu oddechowego, na tle dziedzicznej predyspozycji do chorób alergicznych. Klasyfikacja Klasyfikacja astmy oskrzelowej jest następująca. 1. Etapy rozwoju astmy: 1) wady biologiczne u praktycznie zdrowych ludzi; 2) stan preastmy; 3) klinicznie wyraźna astma. 2. Warianty kliniczne i patogenetyczne: 1) atopowy; 2) zależne od infekcji; 3) autoimmunologiczny; 4) dyshormonalne; 5) neuropsychiczne; 6) aspirowane; 7) pierwotna zmieniona reaktywność oskrzeli. 3. Nasilenie przebiegu choroby: 1) płuco; 2) umiarkowany; 3) ciężki. 4. Fazy przepływu: 1) zaostrzenie; 2) niestabilna remisja; 3) stabilna remisja (ponad 2 lata). 5. Komplikacje: 1) płucna - niedodma, odma opłucnowa, ostra niewydolność płuc; 2) pozapłucne – serce płucne, niewydolność serca. 6. Według etiologii: 1) atopowe (egzogenne, alergiczne, immunologiczne); 2) nieatopowe (endogenne, nieimmunologiczne). Kliniczne kryteria stopnia BA podano w Tabeli 2. Tabela 2 Kliniczne kryteria oceny ciężkości astmy
stan astmatyczny Stan astmy to nieustanny atak astmy oskrzelowej, charakteryzujący się ostrą obturacyjną niewydolnością oddechową w ciągu dnia. Głównymi cechami wyróżniającymi stan astmatyczny są brak efektu konwencjonalnej terapii rozszerzającej oskrzela oraz bezproduktywny wyniszczający kaszel. Podział stanu astmatycznego przedstawiono w tabeli 3. Tabela 3 Klasyfikacja stanu astmatycznego (Sorokina T.A., 1987)
AS charakteryzuje się ciężką dusznością o charakterze wydechowym z udziałem mięśni pomocniczych klatki piersiowej i przedniej ściany brzucha w akcie oddychania, któremu towarzyszy zmiana koloru skóry - bladość, przekrwienie, sinica. Skóra może być sucha i gorąca lub zimna i wilgotna. Charakterystyczny jest tachypnea, częstość oddechów wynosi zwykle ponad 30 na 1 min. Osłuchowe nasłuchiwanie dźwięków muzycznych związanych z przechodzeniem powietrza przez zwężone oskrzeliki. Wraz z postępem procesu pojawia się dobrze znane zjawisko „stref ciszy” płuc, co wskazuje na niedrożność oskrzeli tego obszaru płuc. Charakteryzuje się tachykardią, podwyższonym ciśnieniem krwi i rzutem serca (MOS). Zmniejszone skurczowe ciśnienie krwi podczas wdechu. Rozwija się odwodnienie i hipowolemia. Utrata płynów następuje głównie przez drogi oddechowe i skórę. Objętość krwi krążącej (CBV) jest zwykle zmniejszona średnio o 10% i bardzo rzadko wzrasta. Znacznie zwiększa lepkość krwi i hematokryt do 0,50-0,60, co stwarza realne zagrożenie zatorowością płucną i wymaga wyznaczenia heparyny. Stężenie białek wzrasta, ogólne odwodnienie objawia się pragnieniem, suchością języka, zwiększoną osmolalnością osocza i skąpomoczem. Centralne ciśnienie żylne (CVP) obniża się do 2-5 cm wody. Sztuka. Hipowolemia predysponuje do zapaści, co jest szczególnie ważne przy przenoszeniu pacjentów do wentylacji mechanicznej. Początkowo pojawia się podniecenie, potem zaburzenia psychiczne i „panika oddechowa”, co wiąże się z uczuciem braku powietrza. W przyszłości pojawia się drażliwość, dezorientacja, letarg (aż do odrętwienia i śpiączki). Rozwija się kwasica oddechowa. Leczenie doraźne stanu astmatycznego Terapia tlenowa. Zwilżony tlen jest wdychany2 przez cewniki donosowe lub przez maskę z szybkością 1-2 l / min. Adrenalina stymuluje receptory a1-, b1- i b2-adrenergiczne, rozszerza oskrzela i zmniejsza opór dróg oddechowych. Podaje się podskórnie: o masie ciała poniżej 60 kg – 0,3 ml, o masie ciała od 60 do 80 kg – 0,4 ml, o masie powyżej 80 kg – 0,5 ml. Eufillin hamuje fosfodiesterazę, która przyczynia się do akumulacji cAMP i usuwania skurczu oskrzeli. Przepisując aminofilinę, należy wziąć pod uwagę przeciwwskazania, w tym palenie i dzieciństwo, niewydolność serca i ostry zespół wieńcowy, przewlekłe choroby płuc, wątroby i nerek. W przypadku AS dawka nasycająca aminofiliny wynosi 3-6 mg/kg, podaje się ją dożylnie przez 20 minut. Następnie przeprowadza się podtrzymujący wlew kroplowy leku z szybkością 0,6 mg/kg na 1 godzinę dla pacjenta bez współistniejącej patologii, 0,8 mg/kg na 1 godzinę dla palacza, 0,2 mg/kg na 1 godzinę dla zastoinowego niewydolność serca, zapalenie płuc , choroby wątroby i nerek, 0,4 mg / kg na 1 godzinę w przypadku ciężkich przewlekłych chorób płuc. Efekt terapii kortykosteroidami jest związany z tłumieniem zapalenia dróg oddechowych i zwiększoną wrażliwością na leki b-adrenergiczne. Im cięższy AS, tym większe wskazanie do natychmiastowej terapii kortykosteroidami. Początkowo należy podać dużą dawkę kortykosteroidów. Minimalna dawka to 30 mg prednizolonu lub 100 mg hydrokortyzonu lub 4 mg deksametazonu (celeston). Jeśli terapia jest nieskuteczna, dawkę zwiększa się. Przynajmniej co 6 godzin podaje się odpowiednie równoważne dawki tych leków. Większości pacjentów pokazano terapię wziewną agonistami receptorów beta-adrenergicznych; (fenoterol, alupent, salbutamol). Wyjątkiem są przypadki przedawkowania leków sympatykomimetycznych. Jeżeli trwająca terapia nie daje efektu, wskazane jest dożylne podanie agonistów receptorów beta-adrenergicznych, takich jak izoproterenol, rozcieńczony w 5% roztworze glukozy. Przeciwwskazaniami są choroby serca (miażdżyca naczyń wieńcowych, zawał mięśnia sercowego), ciężki tachykardia i objawy tachyfilaksji, podeszły wiek. Szybkość podawania izoproterenolu wynosi 0,1 μg / kg na 1 min do początku tachykardii (HR 130 na 1 min lub więcej). Terapia infuzyjna jest najważniejszym elementem leczenia AS, mającym na celu uzupełnienie niedoboru płynów i wyeliminowanie hipowolemii, całkowita objętość terapii infuzyjnej wynosi 3-5 litrów na dobę. Hydratację przeprowadza się poprzez wprowadzenie roztworów zawierających wystarczającą ilość wolnej wody (roztwory glukozy), a także hipo- i izotonicznych roztworów elektrolitów zawierających sód i chlor. Wskaźnikami odpowiedniego nawodnienia są ustanie pragnienia, mokry język, przywrócenie prawidłowej diurezy, lepsze opróżnianie plwociny i spadek hematokrytu do 0,30-0,40. Znieczulenie halotanem może być stosowane w leczeniu ciężkiego ataku astmy, który nie jest podatny na konwencjonalną terapię. Sztuczna wentylacja płuc. Wskazania do przeniesienia chorych z AS do wentylacji mechanicznej powinny być bardzo surowe, gdyż w tym stanie często powoduje powikłania i charakteryzuje się dużą śmiertelnością. Jednocześnie wentylacja mechaniczna, prowadzona według ścisłych wskazań, jest jedyną metodą, która może zapobiec dalszemu postępowi hipoksji i hiperkapnii. Wskazania do IVL: 1) stały postęp AS pomimo intensywnej terapii; 2) wzrost pCO2 oraz hipoksemię, potwierdzoną serią testów; 3) progresja objawów ze strony OUN i śpiączka; 4) narastające zmęczenie i wyczerpanie. Mukolityki i środki wykrztuśne dzielą się na dwie grupy. 1. Enzymy proteolityczne (trypsyna, chymotrypsyna) działają poprzez rozrywanie wiązań peptydowych glikoprotein, zmniejszając lepkość i elastyczność plwociny. Są skuteczne w śluzowej i ropnej plwocinie, działają przeciwzapalnie, ale mogą powodować krwioplucie i reakcje alergiczne. 2. Pochodne cysteiny stymulują aktywność wydzielniczą w nabłonku rzęskowym drzewa tchawiczo-oskrzelowego (mukosolvan, mukomist), stosuje się jako aerozol 20% roztworu 2-3 ml 2-3 razy dziennie. Wykład nr 6. Stany nagłe w kardiologii 1. Zawał mięśnia sercowego Zawał mięśnia sercowego to rozbieżność między zapotrzebowaniem mięśnia sercowego na tlen a jego dostarczaniem, skutkująca ograniczoną martwicą mięśnia sercowego. Najczęstszą przyczyną jest zakrzep, rzadziej zator, rzadziej skurcz tętnic wieńcowych. Zakrzepicę najczęściej obserwuje się na tle miażdżycowego uszkodzenia tętnic wieńcowych. W obecności blaszek miażdżycowych dochodzi do zawirowania przepływu krwi. Zmiany miażdżycowe rozwijają się w wyniku upośledzenia metabolizmu lipidów, wzrasta krzepliwość krwi, co wiąże się ze zmniejszeniem aktywności komórek tucznych wytwarzających heparynę. Zwiększona krzepliwość krwi i turbulencje przyczyniają się do powstawania skrzepów krwi. Rozpad blaszek miażdżycowych, krwotoki w nich mogą prowadzić do powstawania skrzepów krwi. Czynnikami predysponującymi są płeć męska, wiek powyżej 50 lat, otyłość, dziedziczność, stres psychoemocjonalny, ciężka praca. Klinika i diagnostyka Klasycznie zawał mięśnia sercowego zaczyna się od narastającego bólu za mostkiem, który z natury jest palący i uciskający. Charakteryzuje się rozległym napromieniowaniem bólu ramion (częściej po lewej), pleców, brzucha, głowy, pod lewą łopatką, w lewej żuchwie itp. Pacjenci są niespokojni, niespokojni, czasami zauważają uczucie strachu smierci. Występują oznaki niewydolności serca i naczyń - zimne kończyny, lepki pot itp. Zespół bólowy jest przedłużony i nie ustępuje pod wpływem nitrogliceryny przez 30 minut lub dłużej. Występują różne zaburzenia rytmu serca, spadek ciśnienia krwi lub jego wzrost. Pacjenci subiektywnie odnotowują uczucie braku powietrza. Powyższe objawy są typowe dla okresu I - bolesnego lub niedokrwiennego, których czas trwania waha się od kilku godzin do 2 dni. Obiektywnie wzrost ciśnienia krwi (wtedy spadek); zwiększona częstość akcji serca lub zaburzenia rytmu; podczas osłuchiwania słychać nieprawidłowy ton IV; dźwięki serca są stłumione; na akcent aorty II ton; praktycznie nie ma zmian biochemicznych we krwi, charakterystycznych znaków na EKG. Drugi okres jest ostry (gorączkowy, zapalny), charakteryzujący się występowaniem martwicy mięśnia sercowego w miejscu niedokrwienia. Ból zwykle ustępuje. Czas trwania ostrego okresu wynosi do 2 tygodni. Stan zdrowia pacjenta stopniowo się poprawia, ale ogólne osłabienie, złe samopoczucie i tachykardia utrzymują się. Dźwięki serca są stłumione. Wzrost temperatury ciała w wyniku procesu zapalnego w mięśniu sercowym, zwykle niewielki, do 38°C, pojawia się zwykle w 3 dniu choroby. Pod koniec pierwszego tygodnia temperatura zwykle wraca do normy. Podczas badania krwi stwierdzają: leukocytozę, umiarkowaną, neutrofilową (10-15 tys.) z przesunięciem na pręciki: brak eozynofilów lub eozynopenię; stopniowe przyspieszenie ESR; Pojawia się białko C-reaktywne; zwiększona aktywność transaminaz; zwiększona aktywność dehydrogenazy mleczanowej, fosfokinazy kreatynowej i innych markerów zawału. Kardiospecyficzne są frakcja CPK-MB i troponina sercowa. Trzeci okres (podostry lub bliznowacenie) trwa 4-6 tygodni. Charakterystyczne dla niego jest normalizacja parametrów krwi (enzymów), normalizuje się temperatura ciała, znikają wszystkie inne oznaki ostrego procesu: zmiany EKG, blizna tkanki łącznej rozwija się w miejscu martwicy. Czwarty okres (okres rehabilitacji, rekonwalescencji) trwa od 6 miesięcy do 1 roku. Brak objawów klinicznych. W tym okresie dochodzi do kompensacyjnego przerostu nienaruszonych włókien mięśnia sercowego i rozwijają się inne mechanizmy kompensacyjne. Następuje stopniowe przywracanie funkcji mięśnia sercowego. Ale patologiczna fala Q utrzymuje się na EKG. Nie powinniśmy jednak zapominać o obecności nietypowych postaci zawału mięśnia sercowego, które często występują w praktyce klinicznej. Należą do nich następujące. 1. Postać brzuszna przebiega zgodnie z rodzajem patologii przewodu żołądkowo-jelitowego z bólem w nadbrzuszu, w procesie wyrostka mieczykowatego, w jamie brzusznej, któremu towarzyszą nudności, wymioty. Częściej ta postać (brzucha) zawału mięśnia sercowego występuje z zawałem tylnej ściany lewej komory. Ogólnie rzecz biorąc, opcja jest rzadka. Odprowadzenia EKG II, III i VL. 2. Postać astmatyczna charakteryzuje się objawami astmy sercowej i w rezultacie wywołuje obrzęk płuc. Ból może być nieobecny. Postać astmatyczna występuje częściej u osób starszych z miażdżycą lub w nawrotowym zawale lub w bardzo rozległych zawałach. Występuje duszność, duszenie, kaszel. Osłuchowe w płucach - wilgotne, drobne bulgoczące rzęski. 3. Forma mózgu lub mózg. Jednocześnie na pierwszym planie objawy udaru mózgowo-naczyniowego według rodzaju udaru z utratą przytomności są częstsze u osób starszych ze stwardnieniem naczyń mózgowych. Występują zawroty głowy, nudności, wymioty, ogniskowe objawy neurologiczne. 4. Cicha lub bezbolesna forma jest przypadkowym stwierdzeniem podczas badania lekarskiego. Z objawów klinicznych: nagle zachorowało, pojawiło się ostre osłabienie, lepki pot, potem wszystko, z wyjątkiem osłabienia, znika. Taka sytuacja jest typowa dla zawału serca w starszym wieku iz powtarzającymi się zawałami mięśnia sercowego. Rozwija się nieumotywowany spadek tolerancji wysiłku. 5. Postać arytmiczna: głównym objawem jest napadowy - tachykardia, ból może być nieobecny. Rozpoczyna się objawem częstoskurczu komorowego lub nadkomorowego, bloku przedsionkowo-komorowego II-III stopnia, ostrej blokady nóg pęczka przedsionkowo-komorowego. Ataki Morgagni-Adams-Stokes często występują w otwarciu. W większości przypadków zaburzenia rytmu serca są powikłane niedociśnieniem, wstrząsem arytmogennym i ostrą niewydolnością serca. Oznaki zawału mięśnia sercowego na EKG są następujące: 1) z penetrującym zawałem mięśnia sercowego lub przezściennym (tj. strefa martwicy rozciąga się od osierdzia do wsierdzia): przemieszczenie odcinka ST powyżej izolinii, kształt jest wypukły do góry - jak „koci grzbiet”; fuzja załamka T z odcinkami ST w dniach 1-3; głównym znakiem jest głęboka i szeroka fala Q; zmniejszenie wielkości załamka R, czasami postać QS; charakterystyczne niezgodne zmiany - przeciwne przesunięcia ST i T (na przykład w 1. i 2. standardowym odprowadzeniu w porównaniu do 3. standardowego odprowadzenia); średnio od 3 doby obserwuje się charakterystyczną odwrotną dynamikę zmian w EKG: odcinek ST zbliża się do izolinii, pojawia się jednolite głębokie T. Załamek Q również podlega odwrotnej dynamice, ale zmienione Q i głębokie T mogą utrzymywać się przez całe życie ; 2) z zawałem śródściennym lub nieprzezściennym mięśnia sercowego: nie ma głębokiego załamka Q, przemieszczenie odcinka ST może być nie tylko w górę, ale także w dół. Główne kryteria rozpoznania zawału mięśnia sercowego: 1) objawy kliniczne; 2) znaki elektrokardiograficzne; 3) znaki biochemiczne. Powikłania: zaburzenia rytmu serca, zaburzenia przewodzenia przedsionkowo-komorowego, ostra niewydolność lewej komory: obrzęk płuc, astma sercowa, wstrząs kardiogenny, zaburzenia żołądkowo-jelitowe (niedowład żołądka i jelit, krwawienie z żołądka), zapalenie osierdzia, zakrzepowe zapalenie wsierdzia ciemieniowego, pęknięcie mięśnia sercowego, ostry i przewlekły tętniak serca , zespół Dresslera, powikłania zakrzepowo-zatorowe, dusznica bolesna pozawałowa. Leczenie Leczenie ma na celu zapobieganie powikłaniom, ograniczenie strefy zawałowej, łagodzenie bólu i korekcję niedotlenienia. Usuwanie zespołu bólowego: zacznij od przyjmowania azotanów. W przypadku ciężkiego niedociśnienia wykonuje się neuroleptanalgezję - fentanyl 1-2 ml dożylnie na glukozę, droperydol 0,25% 2 ml na 40 ml 5% roztworu glukozy. Przy niepełnym działaniu morfina 1% 1,0 jest ponownie wprowadzana po godzinie podskórnie lub dożylnie przez strumień; omnopon 2% - 1,0 podskórnie lub dożylnie; promedol 1% - 1,0 podskórnie. Aby wzmocnić efekt przeciwbólowy, złagodzić niepokój, niepokój, podniecenie, zastosować: analgin 50% - 2,0 domięśniowo lub dożylnie; difenhydramina 1% - 1,0 domięśniowo (działanie uspokajające) + chlorpromazyna 2,5% - 1,0 domięśniowo, dożylnie (wzmocnienie działania leku). Aby ograniczyć strefę martwicy, stosuje się antykoagulanty (heparyna 5 tys. jednostek - 1 ml bolus, a następnie dożylne podanie pompy infuzyjnej 1 tys. jednostek na godzinę), leki trombolityczne (fibrynolizyna 6 tys. jednostek kroplówka dożylna; streptaza 250 tys. w soli fizjologicznej kroplówka dożylna ) i leki przeciwpłytkowe (aspiryna, cardiomagnyl, trombo-ACS, Plavix). Zapobieganie i leczenie arytmii. 1. Mieszanina polaryzacyjna, która sprzyja przenikaniu potasu do komórek. 2. Lekiem z wyboru jest lidokaina, skuteczniejsza w komorowych zaburzeniach rytmu (bolus 80-100 mg). 3. Cordarone lub amiodaron 450 mg dożylnie w soli fizjologicznej. Biorąc pod uwagę, że cierpi na funkcję pompowania serca, wskazane jest wyznaczenie β-blokerów (egilok 12,5-25 mg) w celu zwiększenia kurczliwości mięśnia sercowego. W przypadku obrzęku kończyn dolnych lub wilgotnych rzęsek w płucach stosuje się leki moczopędne (Lasix w dawce 40-80 mg). Duży nacisk kładzie się na ciśnienie krwi, które należy albo zwiększyć przy niedociśnieniu (dopamina), albo obniżyć (kroplówka dożylna izoket, leki przeciwnadciśnieniowe - enalapryl). Aby wyeliminować niedotlenienie, terapię tlenową przeprowadza się przy użyciu nawilżonego tlenu przez maskę lub cewniki donosowe. 2. Wstrząs kardiogenny Wstrząs kardiogenny jest krytycznym zaburzeniem krążenia z niedociśnieniem tętniczym i objawami ostrego pogorszenia krążenia krwi w narządach i tkankach. Klinika i diagnostyka Głównym objawem diagnostycznym jest znaczne obniżenie skurczowego ciśnienia krwi, które wynosi poniżej 90 mm Hg. Sztuka. Różnica między ciśnieniem skurczowym i rozkurczowym (ciśnienie tętna) wynosi 20 mm Hg. Sztuka. lub jeszcze mniejsze. Ponadto rozwija się klinika gwałtownego pogorszenia perfuzji narządów i tkanek: 1) zaburzenia świadomości od łagodnego letargu do psychozy lub śpiączki, mogą pojawić się ogniskowe objawy neurologiczne; 2) diureza poniżej 20 ml/h. Objawy pogorszenia krążenia obwodowego: blada sinica, marmurkowata, ceglasta, wilgotna skóra; zapadnięte żyły obwodowe, gwałtowny spadek temperatury skóry dłoni i stóp; zmniejszenie przepływu krwi. Wartość CVP może być różna. Normalne wskaźniki CVP to 5-8 cm wody. Sztuka.; wskaźnik poniżej 5 cm wody. Sztuka. wskazuje na hipowolemię i niskie ciśnienie krwi oraz powyżej 8 cm wody. Sztuka. wskazuje na niewydolność prawej komory. Rozpoznanie wstrząsu kardiogennego zwykle nie jest trudne. Trudniej jest określić jego rodzaj i wiodące mechanizmy patofizjologiczne. Przede wszystkim należy odróżnić prawdziwy (skurczowy) wstrząs kardiogenny od wstrząsu arytmicznego, odruchowego (bolesnego), wstrząsu medycznego spowodowanego niewydolnością prawej komory lub wolno postępującym pęknięciem mięśnia sercowego. Prowadząc intensywną opiekę nad pacjentem we wstrząsie, ważne jest, aby wykluczyć przyczyny niskiego ciśnienia krwi, takie jak hipowolemia, tamponada serca, odma prężna, powikłania zakrzepowo-zatorowe, a także nie przeoczyć krwawienia wewnętrznego, np. z nadżerek stresowych lub owrzodzeń przewód pokarmowy. Leczenie Wskazana jest terapia tlenowa nawilżonym tlenem przez maskę lub cewniki donosowe. Antykoagulanty podaje się w bolusie w dawce 10 000 IU, a następnie podaje się dożylnie za pomocą pompy infuzyjnej w dawce 1000 IU na godzinę. Konieczne jest wprowadzenie leków przeciwbólowych: morfina 1% 1,0 ml podskórnie lub dożylnie strumieniem; analgin 50% 2 ml domięśniowo, dożylnie. Toniki naczyniowe: Cordiamin 1-4 ml dożylnie; mezaton 1% 1,0 g podskórnie, dożylnie, w soli fizjologicznej; noradrenalina 0,2% 1,0 dożylnie. Prawdziwy wstrząs kardiogenny jest traktowany w następujący sposób. W celu zwiększenia aktywności skurczowej mięśnia sercowego stosuje się: strofantyna 0,05% 0,5-0,75 g dożylnie powoli na 20,0 roztwór izotoniczny, korglukon 0,01 g dożylnie, również w roztworze izotonicznym lub w mieszaninie polaryzacyjnej, glukagon 2-4 mg dożylnie kapać na roztwór polaryzacyjny. Normalizacja ciśnienia krwi: norepinefryna 0,2% 2-4 ml na 1 litr 5% roztworu glukozy lub roztworu izotonicznego. Ciśnienie krwi utrzymuje się na poziomie 100 mm Hg. Art., mezaton 1% 1,0 g dożylnie; kordiamina 2-4 ml, dopamina 200 mg w 400 ml reopolyglucyny lub 5% glukozy. Przy niestabilnym działaniu powyższych leków stosuje się hydrokortyzon 200 mg, prednizolon 90-120 mg. Normalizacja właściwości reologicznych krwi (ponieważ koniecznie tworzą się zakrzepy mikronaczyniowe, zaburzone jest mikrokrążenie). Eliminacja hipowolemii, ponieważ występuje pocenie się płynnej części krwi: reopoliglyukin, polyglukin - w objętości do 100 ml z szybkością 50,0 ml na minutę. Korekta równowagi kwasowo-zasadowej (zwalczanie kwasicy): wodorowęglan sodu 5% do 200,0 ml. Ponowne wprowadzenie środków przeciwbólowych. Przywracanie zaburzeń rytmu i przewodzenia. Ale zawsze konieczne jest kontrolowanie CVP, co pozwala resuscytatorowi określić dopuszczalną terapię infuzyjną. Pacjenci we wstrząsie kardiogennym nie powinni być obciążani wodą. Im wyższy CVP, tym mniej terapii infuzyjnej. 3. Kryzys nadciśnieniowy Przełom nadciśnieniowy to nagły wzrost ciśnienia krwi do poziomu, który zwykle nie jest charakterystyczny dla tego pacjenta, prowadzący do ostrych regionalnych zaburzeń krążenia i uszkodzenia narządów docelowych (serca, mózgu, nerek, jelit). Czynnikami zewnętrznymi wywołującymi kryzys mogą być: 1) stres psychoemocjonalny; 2) wpływy meteorologiczne; 3) nadmierne spożycie soli kuchennej. Wiosną i jesienią kryzysy występują częściej niż zimą i latem. Kryzysy mogą również wystąpić na tle zaostrzenia wielu chorób przewlekłych. MS Kushakovsky (1982) wyróżnia następujące warianty kryzysów nadciśnieniowych: neurowegetatywne, wodno-solne, konwulsyjne (encefalopatia). Klinika Kliniczne objawy przełomu objawiają się szumami w uszach, miganiem much przed oczami, pękającym bólem głowy w okolicy potylicznej, nasilonym przy pochylaniu się, wysiłku, kaszlem, nudnościami, wymiotami i zaburzeniami rytmu serca. Podczas kryzysu dochodzi do niebezpiecznych naruszeń wieńcowych mózgu, rzadziej krążenia nerkowego i brzusznego, co prowadzi do udaru, zawału mięśnia sercowego i innych poważnych powikłań. EKG ujawnia przerost lewej komory. RTG klatki piersiowej pokazuje powiększenie serca, deformację aorty w postaci cyfry „3”, lichwę żeber w wyniku zwiększonego pobocznego przepływu krwi przez tętnice międzyżebrowe. Aortografia potwierdza diagnozę. Postać neurowegetatywna kryzysu charakteryzuje się nagłym początkiem, pobudzeniem, przekrwieniem i wilgocią skóry, tachykardią, częstym obfitym oddawaniem moczu, dominującym wzrostem ciśnienia skurczowego ze wzrostem amplitudy tętna. Takie kryzysy są inaczej nazywane kryzysami nadnerczy lub kryzysami typu I. Kryzysy typu I mają zwykle stosunkowo łagodny przebieg, chociaż mogą prowadzić do napadowych zaburzeń rytmu serca lub dusznicy bolesnej, aw ciężkich przypadkach do zawału mięśnia sercowego. W przypadku kryzysu w postaci soli wodno-solnej stan pogarsza się stopniowo, obserwuje się senność, osłabienie, letarg, dezorientację, bladość i obrzęk twarzy oraz obrzęk. Ciśnienie skurczowe i rozkurczowe wzrasta równomiernie lub z przewagą tego ostatniego i spadkiem ciśnienia tętna. Takie kryzysy nazywane są kryzysami typu II. Kryzysy typu II są z reguły ciężkie i mogą być powikłane zawałem mięśnia sercowego, udarem mózgu, ostrą niewydolnością lewej komory. Konieczne jest podkreślenie kryzysów nadciśnieniowych, które powstają w wyniku nagłego zaprzestania trwałej terapii hipotensyjnej, w szczególności przyjmowania β-blokerów, nifedypiny, leków sympatykolitycznych, a zwłaszcza klonidyny. Leczenie Leczenie przełomu nadciśnieniowego polega na nagłym obniżeniu ciśnienia krwi do normalnego poziomu, niezbędnym do zapobiegania lub ograniczania uszkodzeń narządów docelowych w nadciśnieniu, w celu zapobiegania powikłaniom aż do śmierci w najcięższych przypadkach lub trwałej niepełnosprawności w rozwoju udaru mózgu , zawał mięśnia sercowego. W neurowegetatywnej postaci kryzysu zwykle stosuje się strumień dożylny, powolne podawanie 0,1 mg klonidyny lub powtarzane wlewy dożylne 50 mg labetalolu. Działanie hipotensyjne klonidyny można wzmocnić przez podjęzykowe podanie 10 mg nifedypiny. W skrajnie ciężkich przypadkach nitroprusydek sodu wstrzykuje się dożylnie, a przy jego braku kroplówkę dożylną lub bardzo powoli frakcyjnie - do 50 mg pentaminy. Główne zagrożenia i powikłania terapii hipotensyjnej: 1) niedociśnienie tętnicze; 2) naruszenie krążenia mózgowego (udar krwotoczny lub niedokrwienny, encefalopatia); 3) obrzęk płuc; 4) dusznica bolesna, zawał mięśnia sercowego; 5) tachykardia. Zagrażające życiu kryzysy nadciśnieniowe są podstawą do natychmiastowej intensywnej opieki. Rodzaje kryzysów nadciśnieniowych. 1. Konwulsyjna postać przełomu nadciśnieniowego (ostra ciężka encefalopatia nadciśnieniowa). 2. Kryzys z guzem chromochłonnym. 3. Ostre nadciśnienie tętnicze w chorobach i stanach zagrażających życiu (ostry zespół wieńcowy, ostry zawał mięśnia sercowego, tętniak rozwarstwiający aorty, krwawienie wewnętrzne). 4. Przełom nadciśnieniowy powikłany obrzękiem płuc lub udarem krwotocznym. Konwulsyjna postać przełomu nadciśnieniowego (ostra ciężka encefalopatia nadciśnieniowa) rozwija się w złośliwej postaci nadciśnienia tętniczego lub wtórnego nadciśnienia tętniczego, na przykład w późnej zatruciu kobiet w ciąży lub ostrym kłębuszkowym zapaleniu nerek. Kryzysy zaczynają się silnym pulsującym, łukowatym bólem głowy, pobudzeniem psychoruchowym, powtarzającymi się nieprzynoszącymi ulgi wymiotami, zaburzeniami widzenia; szybko następuje utrata przytomności i pojawiają się drgawki kloniczno-toniczne. U pacjentów ze świeżym nadciśnieniem tętniczym (z ostrym kłębuszkowym zapaleniem nerek, zatruciem kobiet w ciąży) może rozwinąć się napadowy przełom nadciśnieniowy ze stosunkowo niewielkim wzrostem ciśnienia krwi. W konwulsyjnej postaci kryzysu opieka w nagłych wypadkach ma na celu wyeliminowanie zespołu konwulsyjnego i nagłe obniżenie ciśnienia krwi. Zespół drgawkowy jest eliminowany przez dożylne podanie diazepamu. Dodatkowo 10 ml 25% roztworu siarczanu magnezu można podać dożylnie w kroplówce, wolnym strumieniem lub domięśniowo. Nitroprusydek sodu, labetalol, diazoksyd stosuje się w celu pilnego obniżenia ciśnienia krwi. W celu zwalczania obrzęku mózgu wskazane jest dożylne podawanie lasixa. W przypadku rzucawki, zwłaszcza przy podawaniu dożylnym, nadal szeroko stosuje się siarczan magnezu, który podaje się w dawce 4 g na 100 ml 5% roztworu glukozy. Następnie, jeśli to konieczne, wykonuje się wstrzyknięcie kroplowe leku lub zamiast kolejnego kroplowego wstrzyknięcia siarczanu magnezu można głęboko domięśniowo wstrzyknąć 20 ml 25% roztworu siarczanu magnezu. Należy unikać dożylnego podawania siarczanu magnezu, jeśli kobieta w ciąży jest leczona antagonistami wapnia (gwałtowny spadek ciśnienia krwi jest niebezpieczny). Być może z rzucawką i dożylnym podaniem chlorpromazyny (100-250 mg), diazoksydu (300 mg). Seduxen (diazepam) podaje się dożylnie powoli (20-30 mg), a następnie wkrapla (300 mg w 500 ml 5% roztworu glukozy). Kryzys guza chromochłonnego objawia się nagłym, bardzo szybkim i gwałtownym wzrostem ciśnienia krwi, głównie skurczowego oraz wzrostem ciśnienia tętna, któremu towarzyszy bladość skóry, zimne poty, kołatanie serca, ból w sercu i nadbrzuszu, nudności, wymioty , pulsujący ból głowy, zawroty głowy. Podczas kryzysu możliwy jest wzrost temperatury ciała, zaburzenia widzenia i słuchu. Charakteryzuje się spadkiem ciśnienia krwi po przejściu do pozycji pionowej. Opieka w nagłych wypadkach w przypadku kryzysu z guzem chromochłonnym rozpoczyna się od podniesienia wezgłowia łóżka pod kątem 45 °, co powoduje obniżenie ciśnienia krwi. W doraźnej terapii hipotensyjnej lekiem z wyboru jest fentolamina, która podawana jest dożylnie w strumieniu 5 ml co 5 minut. W tym samym celu stosuje się dożylną iniekcję 50 ml labetalolu co 5 minut lub wlew kroplowy 30 ml nitroprusydku sodu w 300 ml 5% roztworu glukozy. Jako dodatkowy lek może być przydatny droperydol (5-10 ml IV). W celu stłumienia tachykardii przepisuje się propranolol w dawce 20-40 mg. W ostrym zawale mięśnia sercowego (szczególnie często stwierdzanym w jego przedniej lokalizacji), gdy podczas kryzysu wzrasta obciążenie mięśnia sercowego, wzrasta zapotrzebowanie mięśnia sercowego na tlen, należy najpierw powstrzymać silny atak bólu za pomocą nowoczesnych środków przeciwbólowych (w tym narkotycznych leków przeciwbólowych ) i podawać środki uspokajające, które mogą znacznie obniżyć ciśnienie krwi. Jeśli znaczne nadciśnienie utrzymuje się, a jednocześnie wzrasta napięcie współczulnego układu nerwowego, wówczas podaje się dożylnie β-blokery (propranolol, metoprolol, esmolol), co wraz z działaniem hipotensyjnym może ograniczyć obszar perystaltyki -zawał niedokrwienie mięśnia sercowego. Często uciekaj się do dożylnego podawania nitrogliceryny, aby spowodować zmniejszenie obciążenia wstępnego i następczego. Pozwala to kontrolować poziom ciśnienia krwi. Należy jednak unikać wyznaczania nitroprusydku sodu, który w tych przypadkach może nasilać niedokrwienie mięśnia sercowego, najwyraźniej ze względu na zjawisko "kradnięcia wieńcowego" (zmniejszenie obocznego przepływu wieńcowego do strefy niedokrwienia). Jeżeli nadciśnienie utrzymuje się po ostrej fazie zawału mięśnia sercowego, rozpoczyna się leczenie głównymi lekami przeciwnadciśnieniowymi, biorąc pod uwagę wskazania i przeciwwskazania. Jednak w ostatnich latach, w związku z danymi dotyczącymi profilaktyki wtórnej, najczęściej preferowane są beta-blokery i inhibitory ACE, które przy braku przeciwwskazań stara się przepisywać od wczesnego okresu. Wraz z rozwojem ostrej niewydolności serca przełom nadciśnieniowy zostaje zatrzymany przez dożylne podanie nitrogliceryny (przeciwwskazane w ciężkim zwężeniu zastawki mitralnej); przepisać leki rozszerzające naczynia krwionośne (choć często rozwija się na nie tolerancja), IFKA. Przy uporczywym nadciśnieniu w przypadku ciężkiej niewydolności serca stosuje się kombinację z diuretykami, a nawet małe dawki diuretyku tiazydowego wraz z diuretykiem oszczędzającym potas (triamteren lub amiloryd) mogą nie tylko normalizować ciśnienie krwi, ale także zapobiegać występowaniu zaburzeń rytmu serca spowodowanych niedoborem potasu i magnezu u tych pacjentów. (Metelitsa VI, 1996). W udarze krwotocznym lub krwotoku podpajęczynówkowym ciśnienie krwi należy szczególnie ostrożnie obniżać za pomocą leków, których działanie hipotensyjne można łatwo kontrolować (nitroprusydek sodu) i do poziomu wyższego niż zwykle (działanie). Każde obniżenie ciśnienia krwi, któremu towarzyszy pogorszenie stanu neurologicznego, należy uznać za nadmierne. W przypadku obrzęku płuc podaje się dożylnie nitroglicerynę lub nitroprusydek sodu lub pentaminę, a także lasix w celu pilnego obniżenia ciśnienia krwi. W przypadku rozwarstwienia tętniaka lub pęknięcia aorty dożylnie w celu regulacji ciśnienia krwi i przygotowania do leczenia operacyjnego podaje się następujące leki: nitroprusydek sodu, diuretyki pętlowe (furosemid), nifedypina, propranolol (wraz z nitroprusydkiem sodu), metylodopa, rezerpina (jako dodatek agent). W kryzysach spowodowanych wzrostem pojemności minutowej serca często obserwuje się tachykardię i dominujący wzrost ciśnienia skurczowego i tętna, dobrym efektem w tych przypadkach jest dożylne podanie anapryliny, a następnie, jeśli to konieczne, furosemidu. 4. Zagrażające życiu zaburzenia rytmu Arytmia Arytmia to rytm serca inny niż zatokowy. Normalny rytm serca ma następujące cechy: 1) tętno od 60 do 120 na minutę; 2) węzeł zatokowy jest stymulatorem, o czym świadczy dodatni załamek P poprzedzający zespół QRS w standardowym odprowadzeniu II i ujemny w AVR; 3) odstępy RR różnią się nie więcej niż 0,01 s; 4) rzeczywiste wskaźniki, odzwierciedlające wielkość odstępów i zębów w normie. Wszystkie zmiany na EKG przeprowadzane są w II standardowym odprowadzeniu. Klasyfikacja arytmii 1. Naruszenie powstawania impulsów: 1) w węźle zatokowym: a) częstoskurcz zatokowy; b) bradykardia zatokowa; c) arytmia zatokowa; d) zespół chorej zatoki (SSS); 2) ektopowe arytmie: a) ekstrasystolia; b) częstoskurcz napadowy; c) migotanie i trzepotanie przedsionków; d) migotanie i trzepotanie komór. 2. Naruszenie przewodzenia impulsów: 1) dodatkowe ścieżki (pakiety Kent); 2) blok serca: a) przedsionkowy (wewnątrzprzedsionkowy); b) przedsionkowo-komorowy; c) dokomorowe. Mechanizmy arytmii Spadek potencjału spoczynkowego, próg pobudliwości występuje tylko na podstawie niedoboru komórkowego potasu, stosunek „osocze – komórka” (normalnie 80 meq potasu znajduje się w komórce i 5 meq w osoczu). Asymetria ogniska elektrofizjologiczno-metabolicznego mięśnia sercowego z powodu niedokrwienia, zapalenia, reperfuzji podczas trombolizy. Osłabienie elektrofizjologiczne stymulatora górnego. Wrodzone dodatkowe ścieżki przewodzenia. Napadowy częstoskurcz nadkomorowy Napadowy częstoskurcz nadkomorowy to nagły atak kołatania serca z częstotliwością 150-250 uderzeń na minutę. Istnieją 3 formy: 1) przedsionkowy; 2) węzłowy; 3) komorowy. Etiologia częstoskurczu napadowego nadkomorowego jest częściej związana ze wzrostem aktywności współczulnego układu nerwowego. Klinicznie objawia się nagłym atakiem bicia serca, naczynia szyi pulsują, czynność serca przechodzi w inny rytm. Czas trwania ataku wynosi od kilku minut do kilku dni. Liczba uderzeń serca w postaci komorowej mieści się zwykle w zakresie 150-180 uderzeń na minutę, przy formach nadkomorowych - 180-240 uderzeń na minutę. Podczas ataku rytm wahadłowy jest charakterystyczny osłuchowo, nie ma różnicy między tonem I i II. Zwiększa zapotrzebowanie mięśnia sercowego na tlen i może wywołać atak ostrej niewydolności wieńcowej. Znaki EKG 1. Zespoły QRS nie ulegają zmianie. 2. W formie nadkomorowej fala P łączy się z T. Leczenie rozpoczyna się od dożylnego podania kordaronu w dawce 300 mg lub nowokainamidu do 1 g, a następnie bolusu adenozyny 1 ml - 1% (10 mg). Antagoniści wapnia werapamil (Isoptin) podaje się dożylnie w postaci bolusa w dawce 2,5-5 mg przez 2-4 minuty. Ale jest używany w wąskich zespołach QRS, a dla szerokich może migotać. Możliwe jest przyjmowanie beta-blokerów (propranolol 20-40 mg podjęzykowo). Paroksyzm migotania przedsionków Napad migotania przedsionków charakteryzuje się brakiem kompleksów przedsionkowych, a zamiast izoliny wykrywane są fale piłokształtne trzepotania przedsionków, które są najbardziej wyraźne w odprowadzeniach II, III i VF z częstotliwością 250-400 uderzeń na minutę. Lub nie ma kompleksów przedsionkowych, wykrywane są fale migotania, oscylacje izoliny o dużej lub małej fali, częstotliwość fal przedsionkowych wynosi 350-600 uderzeń na minutę. Klinika. Puls jest arytmiczny z falami o różnym wypełnieniu, obecnością deficytu tętna (różnica między częstością akcji serca a tętnem); różne interwały i różna głośność tonów serca podczas osłuchiwania. Leczenie. W przypadku napadu zaczyna się od podania 0,25 mg digoksyny (1 ml 0,025%) na 20 ml soli fizjologicznej w postaci bolusa dożylnego. Aby osiągnąć pożądany efekt nasycenia glikozydami, zaleca się dawkę 1,5 mg digoksyny dziennie lub 3 dni. W przypadku niepowikłanego napadu lekiem z wyboru jest nowokainamid, podawany powoli dożylnie w dawce do 2000 ml w ciągu 30 minut (10 ml 10% roztworu) przy stałym monitorowaniu ciśnienia krwi, częstości akcji serca, EKG. Trzepotanie przedsionków jest leczone za pomocą terapii impulsami elektrycznymi. Napadowy częstoskurcz komorowy Napadowy częstoskurcz komorowy charakteryzuje się wykryciem 3 lub więcej kolejnych szerokich (powyżej 0,12 s) zespołów QRS z częstotliwością 100-250 uderzeń na minutę z niezgodnym przesunięciem odcinka ST i załamka T w kierunku przeciwnym do główna fala zespołu QRS. Piruet, czyli dwukierunkowy, wrzecionowaty częstoskurcz komorowy występuje przy wydłużeniu odstępu QT.W tym przypadku rejestruje się nieregularny rytm z częstością akcji serca 150-250 uderzeń na 1 min z szerokimi polimorficznymi zdeformowanymi zespołami QRS. Leczenie. W warunkach hipodynamii krążenia krwi wymagana jest terapia impulsami elektrycznymi, po której przeprowadza się terapię podtrzymującą za pomocą kroplówki z lidokainą. W warunkach stabilnej hemodynamiki lekiem z wyboru jest lidokaina, dożylnie w bolusie 1-2 mg/kg (80-100 mg) przez 3-5 minut, a następnie wlew kroplowy w ciągu dnia w dawce 4 mg/min. Ekstrasystolia komorowa Ekstrasystolia komorowa to wystąpienie niezwykle szerokiego, zdeformowanego zespołu QRS, niezgodne przesunięcie odcinka ST i T, pełna pauza kompensacyjna (odstęp między przed- i po ekstrasystolicznym załamku P jest równy dwukrotności normalnego odstępu RR). Lekem z wyboru jest lidokaina, którą podaje się zgodnie z powyższym schematem. Być może zastosowanie cordarone w dawce 300-450 mg dożylnie w kroplówce. Naruszenie przewodzenia AV wraz z rozwojem omdleń (zespół Morgagni-Adams-Stokes) Gdy przewodnictwo jest zaburzone, dochodzi do różnego rodzaju blokad serca, następuje spowolnienie lub całkowite ustanie przewodzenia impulsu przez układ przewodzący serca. Blokada zatokowo-uszna charakteryzuje się dysfunkcją limfocytów T i upośledzeniem przewodzenia impulsów z węzła zatokowego do przedsionków. Istnieją 3 stopnie. I stopień - spowolnienie impulsu. Na EKG - wydłużenie odstępu PQ o ponad 0,20 s. Wypadanie zespołu QRS. Odstęp RR jest stabilny. II stopień - utrata części impulsów, niepełne przewodzenie. Mobitz typu I - w miarę przechodzenia impulsów odstęp PQ stopniowo wydłuża się aż do całkowitego zaniku fali tętna. QRS nie ulega zmianie. W miejscu wypadnięcia zespołu QRS największa odległość to RR. Prognostycznie ten typ jest stosunkowo korzystny. Mobitz typu II ze stałym odstępem PQ i niezmienionym zespołem QRS. Jednocześnie nie wszystkie impulsy docierają do komór - w niektórych przypadkach realizowany jest co drugi impuls, w innych - co trzeci itd., czyli występuje okresowe wypadanie zespołu QRS 3: 2, 4: 3 , 5: 6 itd. re. III stopień - całkowita blokada przewodzenia. W tym samym czasie przewodzenie impulsów do komór całkowicie się zatrzymuje, w komorach rodzi się ich własne heterotopowe ognisko rytmu idiokomorowego, a im niższy automatyzm, tym trudniejsza klinika. Obserwuje się całkowitą dysocjację: rytm przedsionkowy jest zbliżony do normalnego, a komory mają własną częstotliwość - 40 uderzeń na minutę lub mniej. Ta ostatnia zależy od poziomu uszkodzenia: jeśli cierpi węzeł AV, 40-50 uderzeń na 1 minutę, jeśli odnoga wiązki Jego - 20 uderzeń na 1 minutę lub mniej. Na poziom uszkodzenia wskazuje również stopień deformacji zespołu QRS. Dźwięki serca są osłabione, okresowo pojawia się ton "armaty", gdy skurcz przedsionków i komór prawie pokrywa się w czasie. Może być III dodatkowym tonem. U podstawy serca mogą pojawić się skurczowe szmery wyrzutowe. Często występuje pulsacja żył związana ze skurczem przedsionków, szczególnie wyraźna przy tonie działa Strazhesko. Klinika. Awaria serca, jeśli jeden impuls wypadnie. Zawroty głowy, jeśli wypadnie kilka impulsów. Zespół Morgagni-Adams-Stokes (utrata przytomności), jeśli wypadnie 6-8 kompleksów. Leczenie. Aby przywrócić odpowiedni rytm, atropinę podaje się w dawce od 0,5-1 mg do 3 mg. Co 3 minuty 1 mg do całkowitej dawki 0,4 mg/kg. Antagoniści wapnia - izoptyna 0,04 mg/kg. Przy częstej utracie przytomności pacjent zostaje przeniesiony na stałą terapię elektropulsową. Częściej jednak stymulacja musi odbywać się „na żądanie”. Wykład nr 7. Ostra niewydolność nerek Ostra niewydolność nerek (ARF) jest powikłaniem szeregu chorób nerek i pozanerkowych, charakteryzujących się ostrym pogorszeniem lub ustaniem funkcji nerek i objawiającymi się następującym zespołem objawów: oligonuria, azotemia, przewodnienie, upośledzenie CBS i równowagi wodno-elektrolitowej. Formy OOP obejmują: 1) przednerkowe (hemodynamiczne); 2) nerkowy (miąższowy); 3) zanerkowe (obturacyjne); 4) arena. Etiologia Przyczyny rozwoju przednerkowej ostrej niewydolności nerek. 1. Zmniejszona pojemność minutowa serca (wstrząs kardiogenny, napadowe zaburzenia rytmu serca, tamponada serca, zator tętnicy płucnej, zastoinowa niewydolność serca). 2. Zmniejszone napięcie naczyniowe (posocznica, wstrząs toksyczny zakaźny, wstrząs anafilaktyczny, przedawkowanie leków hipotensyjnych). 3. Zmniejszona efektywna objętość wewnątrznaczyniowa (utrata krwi, utrata osocza, odwodnienie - utrata 7-10% masy ciała, obfite wymioty, biegunka, wielomocz, hipowolemia z nefropatią w ciąży, zespół nerczycowy, zapalenie otrzewnej, marskość wątroby). 4. Naruszenie hemodynamiki wewnątrznerkowej (przyjmowanie NLPZ, inhibitorów ACE, leków nieprzepuszczających promieniowania, sandimmunizacyjnych). 5. Zatrucie wodne - przewodnienie (niekontrolowane wytwarzanie ADH w nowotworach złośliwych, choroby zapalne ośrodkowego układu nerwowego, przedawkowanie leków - leki, barbiturany, przeciwcukrzycowe leki sulfanilamidowe, indometacyna, amitryptylina, cyklofosfamid). Przyczyny rozwoju ostrej niewydolności nerek. 1. Niedokrwienie nerek (wstrząs, odwodnienie). 2. Nefrotoksyczne uszkodzenie spowodowane narażeniem na: 1) leki (aminoglikozydy, NLPZ, środki nieprzepuszczające promieniowania, sulfonamidy, fenacetyna, barbiturany, cefalosporyny, ampicylina, rimfapicin, sandimmune); 2) nefrotoksyny przemysłowe (sole metali ciężkich: rtęć, chrom, kadm, ołów, arsen, platyna, bizmut, złoto, uran, bar); 3) nefrotoksyny domowe (glikol etylenowy, alkohol metylowy, dichloroetan, czterochlorek węgla). 3. Niedrożność kanalików przez pigmenty: 1) hemoglobina (hemoliza - niezgodna transfuzja krwi, zatrucie grzybami, kwas octowy, niedokrwistość hemolityczna, zespół hemolityczno-mocznicowy, zakrzepowa plamica małopłytkowa); 2) moczanów (dna moczanowa, terapia immunosupresyjna szpiczaka mnogiego i białaczki przy dużym wysiłku fizycznym, u osób nieprzystosowanych do upałów); 3) mioglobina (rabdomioliza urazowa, rabdomioliza nieurazowa w śpiączce, uraz elektryczny, odmrożenia, rzucawka, miopatia alkoholowa i heroinowa, ciężka hipokaliemia i hipofosfatemia, zatrucie tlenkiem węgla, sole rtęci, cynk, miedź, leki, wirusowe zapalenie mięśni, przedawkowanie statyny i fibraty); 4) procesy zapalne: OTIN o genezie leczniczej i zakaźnej (AIDS, HFRS, odra, mononukleoza, leptospiroza, mykoplazmoza, riketsjoza) ostre odmiedniczkowe zapalenie nerek, ostre kłębuszkowe zapalenie nerek; 5) martwicze zapalenie brodawek (cukrzyca, nefropatia alkoholowa, przeciwbólowa); 6) patologia naczyniowa (zapalenie naczyń - guzkowe zapalenie tętnic, ziarniniak Wegenera, twardzina układowa; zakrzepica tętnic lub żył, obustronny zator tętnic nerkowych, uraz). Przyczyny rozwoju ostrej pozanerkowej niewydolności nerek. 1. Patologia moczowodów: 1) niedrożność (kamień, skrzepy krwi, martwicze zapalenie brodawek); 2) kompresja (guz narządów miednicy, zwłóknienie zaotrzewnowe). 2. Patologia pęcherza moczowego (kamienie, guzy, niedrożność zapalna szyi pęcherza, gruczolak prostaty, zaburzenia unerwienia w uszkodzeniach rdzenia kręgowego oraz neuropatia cukrzycowa). 3. Zwężenie cewki moczowej. Klasyfikacja Klasyfikacja OPN według E.M. Tareeva. 1. Nerka wstrząsowa. 2. Toksyczna nerka. 3. Ostra zakaźna nerka. 4. Niedrożność naczyń. 5. Nerka urologiczna. Opcje przebiegu ostrej niewydolności nerek: cykliczne, nawracające i nieodwracalne. Klinika W przebiegu klinicznym ostrej niewydolności nerek występuje pięć etapów. Etap I ostrej niewydolności nerek jest początkowy, trwa od momentu wystąpienia czynnika etiologicznego do pojawienia się pierwszych objawów. Na tym etapie taktyki terapeutyczne mają na celu wyeliminowanie lub złagodzenie wpływu czynnika etiologicznego: terapię przeciwwstrząsową, uzupełnienie BCC, zwalczanie niewydolności serca, terapię alkalizującą hemolizy wewnątrznaczyniowej, zwalczanie bólu, leczenie stanów septycznych itp. Wraz z etiologicznymi terapia, skurcz naczyń nerkowych jest eliminowany pod kontrolą diurezy godzinowej. Im wcześniej rozpocznie się stymulacja diurezy, tym korzystniejsze rokowanie. Stopień II ostrej niewydolności nerek, czyli oligonury, charakteryzuje się dysfunkcją 70% nefronów. Oddawanie moczu poniżej 500 ml dziennie wskazuje na rozwój skąpomoczu, a jego spadek do 50 ml dziennie. a poniżej wskazuje na bezmocz. Wraz z naruszeniem zdolności nerek do wydalania wody cierpią również funkcje koncentracji i wydalania azotu. W moczu gwałtownie spada ilość elektrolitów i azotu. Na tym etapie zachodzą najbardziej wyraźne zmiany w hemostazie. Leczenie powinno mieć na celu utrzymanie stałego środowiska wewnętrznego, aby zapewnić czas i możliwość regeneracji nabłonka nerek. Stan nadmiernego nawodnienia rozwija się w wyniku utraty elektrolitów podczas wymiotów i biegunki. Dlatego konieczne jest stymulowanie diurezy, ale tylko pod kontrolą ośrodkowego ciśnienia żylnego. Poprawia przepływ krwi przez nerki. Ponieważ konieczne jest ścisłe kontrolowanie diurezy, wykonuje się cewnikowanie pęcherza. Upośledzona funkcja wydalania azotu przez nerki prowadzi do azotemii, dlatego aby maksymalnie zapobiec rozkładowi białek w organizmie, należy wprowadzić odpowiednią ilość węglowodanów (co najmniej 5 g/kg dziennie). Wprowadza się fruktozę i glukozę, dodając do nich ksylitol (sorbitol) w proporcjach 2:1:1, a jeśli nie ma fruktozy, to 3 części glukozy i 1 część sorbitolu. Jeśli przebieg jest ciężki i nie można go leczyć, przeprowadza się sesje hemodializy. Jeśli usunie się czynnik etiologiczny, to po 5-7 dniach leczenia diureza zaczyna wzrastać. Maksymalny czas trwania tego etapu wynosi do 2 tygodni. III etap ostrej niewydolności nerek - wczesna wielomocz. Charakteryzuje się postępującym wzrostem diurezy (o 200-300 ml dziennie) do 3 litrów. Funkcje wydalania i koncentracji azotu w nerkach nie zostały jeszcze w pełni odzyskane, ale stężenie potasu, magnezu i fosforanów stopniowo się normalizuje. Intensywna terapia we wczesnej fazie wielomoczowej powinna obejmować te same środki, co w poprzedniej, z wyjątkiem stymulacji diurezy. Często wymagana jest hemodializa. Istnieje wysokie ryzyko odwodnienia. IV etap ostrej niewydolności nerek - późny wielomocz. Dzienny wzrost moczu sięga 500-1000 ml, a diureza może osiągnąć 8-10 litrów dziennie lub więcej. W nerkach zaczynają się regenerować procesy wymiany jonowej. Utrata potasu, magnezu, fosforu i innych elektrolitów gwałtownie wzrasta, pacjenci są narażeni na odwodnienie i demineralizację. Dlatego na tym etapie dożylnie podaje się elektrolity i płyny. Etap V OPN lub etap odzyskiwania. Funkcja koncentracji nerek zostaje przywrócona. Diureza zaczyna stopniowo spadać do normy (2-3 litry dziennie), a gęstość moczu wzrasta (1008-1028). Aby określić ciężkość choroby i skuteczność leczenia, pacjenci z ostrą niewydolnością nerek są codziennie badani we krwi pod kątem wskaźników CBS, stężenia elektrolitów, hemoglobiny, cukru, całkowitego białka i frakcji białkowych, mocznika, resztkowego i mocznikowego azotu , kreatynina, hematokryt, aw dobowym moczu - gęstość, ilość elektrolitów i azotu. Leczenie Zasady leczenia są następujące. 1. Leczenie wstrząsu: środki przeciwwstrząsowe, glikokortykosteroidy. 2. Uzupełnienie BCC: poliglucyna, reopoliglyukina, osocze, albumina, masa erytrocytów. 3. Leczenie infekcji: odpowiednia antybiotykoterapia. 4. Odwodnienie: izotoniczny, hipertoniczny, hipotoniczny roztwór chlorku sodu, glukozy. 5. Zatrucie truciznami: wprowadza się odtrutki. 6. Nerka urologiczna: eliminacja niedrożności. 7. Niedrożność kanalików: ciągły do 60 godzin intensywny wlew terapia alkalizująca (roztwór 10% mannitolu 3-5 ml/kg/h z izotonicznym roztworem chlorku sodu, wodorowęglan sodu, glukoza 400-600 ml/h, furosemid 30-50 mg/ kg). 8. Eliminacja skurczu naczyń nerkowych: eufillin 2,4% - 10 ml ponownie po 4-6 godzinach, kuranty 0,5% - 2-4-6 ml dożylnie, trental 3-5 mg / kg dziennie, pentamina 0,5-1,0 mg /kg dziennie, benzoheksonium 0,3-0,5 mg/kg dziennie, droperydol 0,12 mg/kg dziennie, dopamina 1,5-3 mg/kg. 9. Stymulacja diurezy (po stabilizacji ciśnienia krwi i eliminacji hipowolemii): aminofilina, mannitol, lasix. 10. Kontrola diurezy godzinowej, ciśnienia krwi, CVP. Wskazania do ostrej hemodializy: hiperkataboliczna ostra niewydolność nerek, brak efektu leczenia zachowawczego w niekatabolicznej ostrej niewydolności nerek przez 2-3 dni, hiperkaliemia powyżej 6-6,5 mmol/l, niewyrównana kwasica metaboliczna z niedoborem zasad powyżej 15 mmol/l, kreatynina we krwi powyżej 600 µmol/l, mocznik we krwi powyżej 30 mmol/l, przewodnienie z rozwojem obrzęku płuc lub mózgu. Wykład nr 8. Ostra niewydolność wątroby Ostra niewydolność wątroby to zespół objawów charakteryzujący się naruszeniem jednej lub więcej funkcji wątroby z powodu ostrego lub przewlekłego uszkodzenia jej miąższu. Etiologia Przyczynami ostrej niewydolności nerek mogą być wirusy zapalenia wątroby typu A, B, C, D, E, G, a także wirusy opryszczki, cytomegalowirus, wirus mononukleozy zakaźnej, półpasiec prosty i półpasiec, Coxsackie, odra, posocznica rozwijająca się z ropniami wątroby i ropne zapalenie dróg żółciowych, narkotyki, alkohol, toksyny przemysłowe, niewydolność serca. OPN zawsze przebiega z uszkodzeniem wielu narządów: w proces zaangażowane są nerki, układ sercowo-naczyniowy, płuca, trzustka i mózg. Upośledzenie czynności nerek objawia się ostrą martwicą kanalików nerkowych. Powikłania płucne - aspiracja treści żołądkowej lub krwi, niedodma, infekcje dróg oddechowych. Ostre zapalenie trzustki i martwica trzustki mogą spowodować śmierć. Rozwija się zagrażające życiu zaburzenie homeostazy. Niewydolność wątroby tłumaczy się dystrofią i rozległą martwicą hepatocytów. Klinika i diagnostyka Objawy kliniczne ARF są następujące. 1. Koagulopatia jest spowodowana niedoborem czynników krzepnięcia i wzrostem aktywności fibrynolitycznej. Predysponuje do samoistnych krwawień z błon śluzowych: obserwuje się krwawienia z przewodu pokarmowego, macicy, nosa. Możliwe są krwotoki mózgowe. Aby ocenić stan układu hemostazy, określa się czas protrombinowy. 2. Hipoglikemia charakteryzuje się wysokim poziomem insuliny w osoczu, co wynika ze zmniejszenia jej wychwytu przez wątrobę. Prowadzi to do szybkiego pogorszenia stanu neurologicznego i śmierci pacjentów. 3. Naruszenia równowagi wodno-elektrolitowej i kwasowo-zasadowej. Schyłkowa ostra niewydolność nerek charakteryzuje się hiponatremią, hipofosfatemią, hipokalcemią i hipomagnezemią. Zmiana stanu kwasowo-zasadowego nie ma jednoznacznego kierunku. Zasadowicę oddechową związaną ze stymulacją ośrodka oddechowego substancjami toksycznymi można zastąpić kwasicą oddechową z powodu podwyższonego ciśnienia śródczaszkowego i zahamowania czynności oddechowej. W rozwoju śpiączki wątrobowej jako ciężkiego przebiegu choroby wyróżnia się stadia przedśpiączkowe, śpiączkę zagrażającą i śpiączkę właściwą. Występują również śpiączka wątrobowokomórkowa (endogenna) powstająca z masywnej martwicy miąższu, portokawalu (bypass, przetoka, egzogenna), z powodu znacznego wykluczenia wątroby z procesów metabolicznych z powodu obecności wyraźnych zespoleń portokawalnych i śpiączka mieszana, występująca głównie w marskości wątroby. W okresie przedśpiączkowym rozwija się postępująca anoreksja, nudności, zmniejszenie wielkości wątroby, wzrost żółtaczki, hiperbilirubinemia i wzrost zawartości kwasów żółciowych we krwi. W przyszłości nasilają się zaburzenia neuropsychiczne, spowolnienie myślenia, depresja, a czasem euforia. Charakteryzuje się niestabilnością nastroju, drażliwością, zaburzenia pamięci, zaburzenia snu. Odruchy ścięgniste są zwiększone, charakterystyczne jest niewielkie drżenie kończyn. Rozwija się Azotemia. Dzięki szybkiej terapii pacjenci mogą wyjść z tego stanu, ale częściej przy ciężkich nieodwracalnych zmianach w wątrobie pojawia się śpiączka. W okresie śpiączki możliwe jest pobudzenie, które następnie zostaje zastąpione depresją (otępieniem) i postępującym upośledzeniem świadomości aż do jej całkowitej utraty. Rozwijają się zjawiska oponowe, odruchy patologiczne, niepokój ruchowy, drgawki. Oddychanie jest zaburzone (takie jak Kussmaul, Cheyne-Stokes); puls jest mały, arytmiczny; jest hipotermia. Twarz pacjenta jest wychudzona, kończyny zimne, z ust i skóry wydobywa się charakterystyczny słodki zapach wątroby, nasilają się zjawiska krwotoczne (krwotoki skórne, krwawienia z nosa, dziąseł, żylaki przełyku itp.). Ostra niewydolność wątroby rozwija się szybko, w ciągu kilku godzin lub dni, a przy odpowiednim czasie leczenia może być odwracalna. Badania laboratoryjne: bilirubina, mocznik i kreatynina we krwi i moczu, parametry układu hemostazy, pełna morfologia i mocz, CVP, EKG, osmolarność osocza i moczu, elektrolity osocza, wolna hemoglobina osocza i moczu, ALT, AST, fosfataza alkaliczna, LDH, CPK, czas protrombinowy. Tomografia komputerowa wątroby może ujawnić zmniejszenie jej wielkości, ale większość klinicystów skupia się na danych klinicznych i laboratoryjnych. Leczenie Wczesne wsparcie inotropowe jest niezbędnym elementem intensywnej pielęgnacji. Zapobieganie powikłaniom infekcyjnym - wyznaczenie antybiotyków cefalosporynowych w połączeniu z lekami przeciwgrzybiczymi (amfoterycyna-B). Hepatoprotektory i leki stabilizujące błony: prednizolon do 300 mg, witamina C 500 mg, troxevasin 5 ml, etamsylan sodu 750 mg, Essentiale 30 ml, tokoferol 4 ml domięśniowo, cytomak 35 mg, kokarboksylaza 300 mg, kwas nikotynowy 30-40 mg, complamin 900 mg, sirepar 5-10 ml, kwas glutaminowy 1% 400 ml, vikasol 10 ml dożylnie, witaminy z grupy B. Inhibitory proteazy, do których zaliczamy korowe 100 tys. jednostek, trasilol 400 tys. jednostek, antagonosan, gordox. Stymulacja diurezy: reogluman 400 ml, mannitol, lasix do 200 mg dożylnie, eufillin 240 mg. W celu skorygowania koagulopatii stosuje się dożylne podawanie witaminy K (10 mg dziennie przez 3 dni). Efekt pojawia się po 3 h. W tym przypadku eliminacja hipoprotrombinemii związanej z zaburzeniami wchłaniania witaminy K, wynikającymi z niedoboru kwasów żółciowych. W przypadku krwawienia lub podejrzenia zabiegów inwazyjnych (cewnikowanie naczyń, dializa otrzewnowa) podaje się dożylnie masę płytkową lub świeżo mrożone osocze. Obrzęk mózgu jest częstą przyczyną śmierci. Mannitol podaje się w ilości 1 g/kg masy ciała. U pacjentów z niewydolnością nerek mannitol jest przepisywany w połączeniu z ultrafiltracją, aby uniknąć hiperosmolarności i przewodnienia. Wraz z rozwojem śpiączki wątrobowej przepisuje się chlorek potasu (0,4-0,5% roztwór w 5% roztworze glukozy o objętości kroplówki dożylnej 500 ml) lub roztwór wodorowęglanu sodu (z kwasicą metaboliczną); Pacjenci oddychają nawilżonym tlenem przez cewnik donosowy. Wraz ze spadkiem ciśnienia tętniczego i żylnego poliglucynę i albuminę podaje się dożylnie. W przypadku wystąpienia masywnych krwawień podejmuje się odpowiednie środki, aby je zatrzymać, przetacza się krew jednej grupy i podaje leki zawierające czynniki krzepnięcia krwi. Przy znaczących objawach rozsianego wykrzepiania wewnątrznaczyniowego heparynę podaje się dożylnie w dawce bolusowej 10 000-15 000 IU. W przypadku niewydolności nerek wykonuje się hemodializę otrzewnową i plazmaferezę, które dają dobry wynik, ale wprowadzenie heparyny jest przeciwwskazane przed tymi manipulacjami. Aby zatrzymać pobudzenie psychomotoryczne i drgawki, przepisuje się diprazynę, haloperidol, oksymaślan sodu. W ciężkich przypadkach należy zastosować intubację i wentylację mechaniczną. Ważne jest, aby pamiętać, że ryzyko krwawienia jest wysokie, dlatego wszystkie manipulacje należy wykonywać z najwyższą ostrożnością. Przy usuwaniu pacjenta ze śpiączki kolejnym krokiem jest przeprowadzenie intensywnej terapii choroby podstawowej. Wykład nr 9. Szok Wstrząs jest formą krytycznego stanu organizmu, objawiającego się dysfunkcją wielonarządową, która kaskaduje na zasadzie uogólnionego kryzysu krążenia i z reguły kończy się śmiercią bez leczenia. Czynnikiem szokowym jest każdy wpływ na organizm, który przekracza siły adaptacyjne. W szoku zmieniają się funkcje oddychania, układu sercowo-naczyniowego i nerek, zaburzone są procesy mikrokrążenia narządów i tkanek oraz procesy metaboliczne. Etiologia i patogeneza Wstrząs to choroba o charakterze polietiologicznym. W zależności od etiologii wystąpienia, rodzaje wstrząsu mogą być różne. 1. Szok traumatyczny: 1) z urazami mechanicznymi - złamania kości, rany, ucisk tkanek miękkich itp.; 2) z oparzeniami (oparzenia termiczne i chemiczne); 3) pod wpływem niskiej temperatury - szok zimny; 4) w przypadku urazów elektrycznych - porażenie prądem. 2. Wstrząs krwotoczny lub hipowolemiczny: 1) rozwija się w wyniku krwawienia, ostrej utraty krwi; 2) w wyniku ostrego naruszenia bilansu wodnego dochodzi do odwodnienia organizmu. 3. Wstrząs septyczny (toksyczny dla bakterii) (uogólnione procesy ropne wywołane przez mikroflorę Gram-ujemną lub Gram-dodatnią). 4. Wstrząs anafilaktyczny. 5. Wstrząs kardiogenny (zawał mięśnia sercowego, ostra niewydolność serca). Rozważane w dziale stany nagłe w kardiologii. We wszystkich rodzajach wstrząsu głównym mechanizmem rozwoju jest rozszerzenie naczyń krwionośnych, w wyniku czego zwiększa się pojemność łożyska naczyniowego, hipowolemia - zmniejsza się objętość krwi krążącej (BCC), ponieważ istnieją różne czynniki: utrata krwi, redystrybucja płyn między krwią a tkankami lub niedopasowanie normalnej objętości krwi zwiększające pojemność naczyń. Wynikająca z tego rozbieżność między BCC a pojemnością łożyska naczyniowego jest przyczyną zmniejszenia pojemności minutowej serca i zaburzeń mikrokrążenia. Ta ostatnia prowadzi do poważnych zmian w ciele, ponieważ tutaj odbywa się główna funkcja krążenia krwi - wymiana substancji i tlenu między komórką a krwią. Następuje pogrubienie krwi, wzrost jej lepkości i mikrozakrzepica wewnątrzkapilarna. Następnie funkcje komórek ulegają zakłóceniu aż do ich śmierci. W tkankach zaczynają dominować procesy beztlenowe nad tlenowymi, co prowadzi do rozwoju kwasicy metabolicznej. Nagromadzenie produktów przemiany materii, głównie kwasu mlekowego, zwiększa kwasicę. Cechą patogenezy wstrząsu septycznego jest naruszenie krążenia krwi pod wpływem toksyn bakteryjnych, co przyczynia się do otwarcia przecieków tętniczo-żylnych, a krew zaczyna omijać łożysko kapilarne i spływa od tętniczek do żyłek. Ze względu na zmniejszenie przepływu krwi włośniczkowej i działanie toksyn bakteryjnych specyficznie na komórkę, odżywianie komórek zostaje zakłócone, co prowadzi do zmniejszenia dopływu tlenu do komórek. We wstrząsie anafilaktycznym, pod wpływem histaminy i innych substancji biologicznie czynnych, naczynia włosowate i żyły tracą napięcie, natomiast obwodowe łożysko naczyniowe rozszerza się, jego pojemność wzrasta, co prowadzi do patologicznej redystrybucji krwi. Krew zaczyna gromadzić się w naczyniach włosowatych i żyłkach, powodując naruszenie czynności serca. Powstający w tym samym czasie BCC nie odpowiada pojemności łożyska naczyniowego, a minimalna objętość serca (pojemność minutowa) odpowiednio się zmniejsza. Wynikająca z tego stagnacja krwi w złożu mikrokrążenia prowadzi do rozpadu metabolizmu i tlenu między komórką a krwią na poziomie złoża kapilarnego. Powyższe procesy prowadzą do niedokrwienia tkanki wątroby i zaburzenia jej funkcji, co dodatkowo zaostrza niedotlenienie w ciężkich stadiach rozwoju wstrząsu. Naruszona detoksykacja, tworzenie białek, tworzenie glikogenu i inne funkcje wątroby. Zaburzenie głównego, regionalnego przepływu krwi i mikrokrążenia w tkance nerkowej przyczynia się do zaburzenia zarówno funkcji filtracji, jak i koncentracji nerek ze zmniejszeniem diurezy od skąpomoczu do bezmoczu, co prowadzi do nagromadzenia odpadów azotowych w organizmie pacjenta. ciała, takie jak mocznik, kreatynina i inne toksyczne substancje produktów przemiany materii. Funkcje kory nadnerczy są upośledzone, zmniejsza się synteza kortykosteroidów (glukokortykoidów, mineralokortykosteroidów, hormonów androgennych), co pogarsza zachodzące procesy. Zaburzenia krążenia w płucach wyjaśniają naruszenie oddychania zewnętrznego, zmniejsza się pęcherzykowa wymiana gazowa, dochodzi do przecieku krwi, powstaje mikrozakrzepica, aw rezultacie rozwój niewydolności oddechowej, która pogarsza niedotlenienie tkanek. Klinika Wstrząs krwotoczny to reakcja organizmu na powstałą utratę krwi (utrata 25-30% BCC prowadzi do silnego wstrząsu). W przypadku wystąpienia wstrząsu oparzeniowego dominującą rolę odgrywa czynnik bólowy i masywna utrata osocza. Szybko rozwijająca się skąpomocz i bezmocz. Rozwój wstrząsu i jego nasilenie charakteryzuje się objętością i szybkością utraty krwi. Na podstawie tego ostatniego rozróżnia się skompensowany wstrząs krwotoczny, zdekompensowany wstrząs odwracalny i zdekompensowany wstrząs nieodwracalny. Przy wstrząsie kompensowanym, bladości skóry, zimnym lepkim pocie, puls staje się mały i częsty, ciśnienie krwi pozostaje w normie lub nieznacznie się zmniejsza, ale nieznacznie zmniejsza się oddawanie moczu. Przy nieskompensowanym odwracalnym wstrząsie skóra i błony śluzowe stają się siniczne, pacjent staje się ospały, puls jest mały i częsty, następuje znaczny spadek ciśnienia tętniczego i ośrodkowego żylnego, rozwija się skąpomocz, zwiększa się wskaźnik Algovera, EKG pokazuje naruszenie zaopatrzenia mięśnia sercowego w tlen. Przy nieodwracalnym przebiegu wstrząsu brak świadomości, ciśnienie krwi spada do wartości krytycznych i może nie zostać wykryte, skóra ma marmurkowy kolor, rozwija się bezmocz - zaprzestanie oddawania moczu. Indeks Algovera jest wysoki. W ocenie nasilenia wstrząsu krwotocznego bardzo ważne jest określenie BCC, czyli objętości utraty krwi. Mapę analizy dotkliwości wstrząsów oraz ocenę uzyskanych wyników przedstawiono w Tabeli 4 i Tabeli 5. Tabela 4 Mapa analizy dotkliwości wstrząsów
Tabela 5 Ocena wyników według sumy punktów
Wskaźnik wstrząsu lub wskaźnik Algovera to stosunek częstości akcji serca do ciśnienia skurczowego. W szoku pierwszego stopnia indeks Algovera nie przekracza 1. W drugim stopniu - nie więcej niż 2; ze wskaźnikiem większym niż 2 stan jest scharakteryzowany jako niezgodny z życiem. Rodzaje wstrząsów Wstrząs anafilaktyczny to zespół różnych reakcji alergicznych typu natychmiastowego, osiągających ekstremalny stopień nasilenia. Istnieją następujące formy wstrząsu anafilaktycznego: 1) postać sercowo-naczyniowa, w której rozwija się ostra niewydolność krążenia, objawiająca się tachykardią, często z zaburzeniami rytmu serca, migotaniem komór i przedsionków oraz spadkiem ciśnienia krwi; 2) postać oddechowa, której towarzyszy ostra niewydolność oddechowa: duszność, sinica, stridor, bulgotanie oddechu, wilgotne rzęski w płucach. Wynika to z naruszenia krążenia kapilarnego, obrzęku tkanki płucnej, krtani, nagłośni; 3) forma mózgowa spowodowana niedotlenieniem, upośledzeniem mikrokrążenia i obrzękiem mózgu. W zależności od ciężkości przebiegu rozróżnia się 4 stopnie wstrząsu anafilaktycznego. Stopień I (łagodny) charakteryzuje się swędzeniem skóry, pojawieniem się wysypki, bólu głowy, zawrotów głowy, uczuciem zaczerwienienia głowy. II stopień (umiarkowany) - obrzęk Quinckego, tachykardia, obniżenie ciśnienia tętniczego, wzrost wskaźnika Algovera łączą się z objawami wskazanymi wcześniej. Stopień III (ciężki) objawia się utratą przytomności, ostrą niewydolnością oddechową i sercowo-naczyniową (duszność, sinica, oddychanie stridorem, mały szybki puls, gwałtowny spadek ciśnienia krwi, wysoki wskaźnik Algovera). Stopień IV (bardzo ciężki) towarzyszy utrata przytomności, ciężka niewydolność sercowo-naczyniowa: puls nie jest określony, ciśnienie krwi jest niskie. Leczenie. Leczenie odbywa się zgodnie z ogólnymi zasadami leczenia wstrząsowego: przywrócenie hemodynamiki, przepływ krwi włośniczkowej, zastosowanie środków zwężających naczynia, normalizacja BCC i mikrokrążenia. Specyficzne środki mają na celu inaktywację antygenu w ludzkim ciele (na przykład penicylinazę lub b-laktamazę we wstrząsie wywołanym antybiotykami) lub zapobieganie wpływowi antygenu na organizm - leki przeciwhistaminowe i stabilizatory błony. 1. Dożylny wlew adrenaliny do stabilizacji hemodynamicznej. Można stosować dopminę 10-15 mcg/kg/min, a przy objawach skurczu oskrzeli i agonistów receptorów beta-adrenergicznych: alupent, brikanil wlew dożylnie. 2. Terapia infuzyjna w objętości 2500-3000 ml z włączeniem poliglucyny i reopolyglucyny, chyba że reakcja jest spowodowana tymi lekami. Wodorowęglan sodu 4% 400 ml, roztwory glukozy do przywrócenia BCC i hemodynamiki. 3. Stabilizatory błony dożylnie: prednizolon do 600 mg, kwas askorbinowy 500 mg, troxevasin 5 ml, etamsylan sodu 750 mg, cytochrom C 30 mg (wskazane dawki dzienne). 4. Leki rozszerzające oskrzela: eufillin 240-480 mg, noshpa 2 ml, alupent (brikanil) 0,5 mg w kroplówce. 5. Leki przeciwhistaminowe: difenhydramina 40 mg (suprastin 60 mg, tavegil 6 ml), cymetydyna 200-400 mg dożylnie (wskazano dawki dzienne). 6. Inhibitory proteazy: trasylol 400 tys. U, Contrical 100 tys. Wstrząs traumatyczny to patologiczny i krytyczny stan organizmu, który powstał w odpowiedzi na uraz, w którym funkcje układów życiowych i narządów są upośledzone i zahamowane. Podczas szoku urazowego rozróżnia się fazy apatii i erekcji. W momencie wystąpienia wstrząs może być pierwotny (1-2 godziny) i wtórny (ponad 2 godziny po urazie). Etap erekcji lub faza występowania. Świadomość pozostaje, pacjent jest blady, niespokojny, euforyczny, nieadekwatny, może krzyczeć, gdzieś biegać, uciekać itp. Na tym etapie uwalniana jest adrenalina, dzięki czemu ciśnienie i puls mogą przez jakiś czas pozostawać w normie. Czas trwania tej fazy wynosi od kilku minut i godzin do kilku dni. Ale w większości przypadków jest krótki. Faza letargu zastępuje fazę erekcji, gdy pacjent staje się ospały i adynamiczny, ciśnienie krwi spada i pojawia się tachykardia. Szacunki ciężkości urazu przedstawiono w Tabeli 6. Tabela 6 Ocena stopnia ciężkości urazu
Po obliczeniu punktów uzyskana liczba jest mnożona przez współczynnik. Uwagi 1. W przypadku obrażeń, które nie są wymienione w wykazie wielkości i ciężkości obrażeń, liczba punktów jest przyznawana zgodnie z rodzajem obrażeń, zgodnie z dotkliwością odpowiadającą jednemu z wymienionych. 2. W przypadku chorób somatycznych, które zmniejszają funkcje adaptacyjne organizmu, znalezioną sumę punktów mnoży się przez współczynnik od 1,2 do 2,0. 3. W wieku 50-60 lat sumę punktów mnoży się przez współczynnik 1,2, starszy - 1,5. Leczenie. Główne kierunki leczenia. 1. Eliminacja działania czynnika traumatycznego. 2. Eliminacja hipowolemii. 3. Eliminacja niedotlenienia. Znieczulenie odbywa się poprzez wprowadzenie środków przeciwbólowych i leków, wdrożenie blokad. Terapia tlenowa, w razie potrzeby intubacja tchawicy. Odszkodowanie za utratę krwi i BCC (osocze, krew, reopolyglucyna, poliglucyna, erytromasa). Normalizacja przemiany materii w miarę rozwoju kwasicy metabolicznej wprowadza się chlorek wapnia 10% - 10 ml, chlorek sodu 10% - 20 ml, glukozę 40% - 100 ml. Walcz z niedoborem witamin (witaminy z grupy B, witamina C). Terapia hormonalna glikokortykosteroidami - prednizolon dożylnie raz 90 ml, a następnie 60 ml co 10 godzin. Stymulacja napięcia naczyniowego (mezaton, norepinefryna), ale tylko przy uzupełnieniu objętości krwi krążącej. Leki przeciwhistaminowe (difenhydramina, sibazon) są również zaangażowane w terapię przeciwwstrząsową. Wstrząs krwotoczny to stan ostrej niewydolności sercowo-naczyniowej, który rozwija się po utracie znacznej ilości krwi i prowadzi do zmniejszenia perfuzji ważnych narządów. Etiologia: urazy z uszkodzeniem dużych naczyń, ostre wrzody żołądka i dwunastnicy, pęknięcie tętniaka aorty, krwotoczne zapalenie trzustki, pęknięcie śledziony lub wątroby, pęknięcie jajowodu lub ciąża pozamaciczna, obecność zrazików łożyskowych w macicy itp. Zgodnie z danymi klinicznymi i wielkością niedoboru objętości krwi rozróżnia się następujące stopnie nasilenia. 1. Nie wyrażone - nie ma danych klinicznych, poziom ciśnienia krwi jest normalny. Objętość utraty krwi wynosi do 10% (500 ml). 2. Słaby - minimalny tachykardia, niewielki spadek ciśnienia krwi, pewne oznaki skurczu naczyń obwodowych (zimne dłonie i stopy). Objętość utraty krwi wynosi od 15 do 25% (750-1200 ml). 3. Umiarkowany - tachykardia do 100-120 uderzeń na minutę, spadek ciśnienia tętna, ciśnienie skurczowe 1-90 mm Hg. Sztuka, niepokój, pocenie się, bladość, skąpomocz. Objętość utraty krwi wynosi od 100 do 25% (35-1250 ml). 4. Ciężkie - tachykardia powyżej 120 uderzeń na minutę, ciśnienie skurczowe poniżej 60 mm Hg. Art., często nie określany przez tonometr, otępienie, skrajną bladość, zimne kończyny, bezmocz. Objętość utraty krwi wynosi ponad 35% (ponad 1750 ml). Laboratorium ogólnej analizy krwi, obniżenia poziomu hemoglobiny, erytrocytów i hematokrytu. EKG pokazuje niespecyficzne zmiany w odcinku ST i załamku T, które są spowodowane niewystarczającym krążeniem wieńcowym. Leczenie wstrząsu krwotocznego obejmuje zatrzymanie krwawienia, zastosowanie terapii infuzyjnej w celu przywrócenia BCC, zastosowanie środków zwężających lub rozszerzających naczynia, w zależności od sytuacji. Terapia infuzyjna polega na dożylnym podaniu płynów i elektrolitów w objętości 4 litrów (sól fizjologiczna, glukoza, albumina, poliglucyna). W przypadku krwawienia wskazane jest przetoczenie krwi jednogrupowej i osocza w łącznej objętości co najmniej 4 dawek (1 dawka to 250 ml). Pokazano wprowadzenie leków hormonalnych, takich jak stabilizatory błon (prednizolon 90-120 mg). W zależności od etiologii przeprowadzana jest specyficzna terapia. Wstrząs septyczny to przenikanie czynnika zakaźnego z jego początkowego ogniska do układu krwionośnego i jego rozprzestrzenianie się po całym ciele. Czynnikami sprawczymi mogą być: bakterie gronkowcowe, paciorkowce, pneumokoki, meningokoki i enterokoki, a także Escherichia, Salmonella i Pseudomonas aeruginosa itp. Wstrząsowi septycznemu towarzyszy dysfunkcja układu płucnego, wątrobowego i nerkowego, naruszenie krwi układ krzepnięcia, który prowadzi do zespołu zakrzepowo-krwotocznego (zespół Machabeli), który rozwija się we wszystkich przypadkach sepsy. Na przebieg sepsy wpływa rodzaj patogenu, co jest szczególnie ważne przy nowoczesnych metodach leczenia. Obserwuje się postępującą anemię laboratoryjną (z powodu hemolizy i ucisku hematopoezy). Leukocytoza do 12 109 / l, jednak w ciężkich przypadkach, gdy powstaje ostre zagłębienie narządów krwiotwórczych, można również zaobserwować leukopenię. Objawy kliniczne wstrząsu bakteryjnego: dreszcze, wysoka gorączka, niedociśnienie, sucha ciepła skóra - najpierw zimna i mokra, bladość, sinica, zaburzenia psychiczne, wymioty, biegunka, skąpomocz. Charakteryzuje się neutrofilią z przesunięciem formuły leukocytów w lewo do mielocytów; ESR wzrasta do 30-60 mm/h lub więcej. Zwiększa się poziom bilirubiny we krwi (do 35-85 µmol/l), co dotyczy również zawartości azotu resztkowego we krwi. Obniża się krzepliwość krwi i wskaźnik protrombiny (do 50-70%), zmniejsza się zawartość wapnia i chlorków. Całkowite białko krwi jest zmniejszone, co następuje z powodu albuminy, a poziom globulin (alfa-globulin i b-globulin) wzrasta. W moczu białko, leukocyty, erytrocyty i cylindry. Obniża się poziom chlorków w moczu, zwiększa się mocznik i kwas moczowy. Leczenie ma przede wszystkim charakter etiologiczny, dlatego przed przepisaniem antybiotykoterapii konieczne jest określenie patogenu i jego wrażliwości na antybiotyki. Środki przeciwdrobnoustrojowe należy stosować w maksymalnych dawkach. W leczeniu wstrząsu septycznego konieczne jest stosowanie antybiotyków, które obejmują całe spektrum drobnoustrojów Gram-ujemnych. Najbardziej racjonalne jest połączenie ceftazydymu i impinemu, które okazały się skuteczne przeciwko Pseudomonas aeruginosa. Leki takie jak klindamycyna, metronidazol, tikarcylina lub imipinem są lekami z wyboru, gdy występuje oporny patogen. Jeśli gronkowce są wysiewane z krwi, konieczne jest rozpoczęcie leczenia lekami z grupy penicylin. Leczenie niedociśnienia znajduje się na pierwszym etapie leczenia w odpowiedniej objętości płynu wewnątrznaczyniowego. Stosować roztwory krystaloidów (izotoniczny roztwór chlorku sodu, mleczan Ringera) lub koloidy (albumina, dekstran, poliwinylopirolidon). Zaletą koloidów jest to, że gdy są wprowadzane, wymagane ciśnienia napełniania są osiągane najszybciej i pozostają takie przez długi czas. Jeśli nie ma efektu, stosuje się wsparcie inotropowe i (lub) leki wazoaktywne. Dopamina jest lekiem z wyboru, ponieważ jest kardioselektywnym beta-agonistą. Kortykosteroidy zmniejszają ogólną odpowiedź na endotoksyny, pomagają obniżyć gorączkę i dają pozytywny efekt hemodynamiczny. Prednizolon w dawce od 60 do 90 mg na dobę. Wykład nr 10. Ostre zatrucie Ostre zatrucie - choroby o etiologii chemicznej, których obraz kliniczny rozwija się po jednorazowym spożyciu chemikaliów do organizmu ludzkiego w toksycznej dawce, która może powodować naruszenia funkcji życiowych i zagrażać życiu. W zależności od przyczyny i miejsca wystąpienia rozróżnia się następujące rodzaje zatruć. 1. Przypadkowe zatrucie (wypadki) przy pracy - narażenie na trucizny przemysłowe podczas wypadku lub z naruszeniem zasad bezpieczeństwa technicznego w okresie pracy z substancjami szkodliwymi; w życiu codziennym - gdy dochodzi do błędnego lub nieprawidłowego stosowania chemii gospodarczej, w przypadku samoleczenia lekami, ich przedawkowania lub błędnego stosowania, przy zatruciu alkoholem i narkotykami, ukąszeniach jadowitych owadów i węży; błędy medyczne. 2. Celowe zatrucia - zatrucia samobójcze (prawdziwe lub demonstracyjne) i kryminalne (w celu zabicia lub doprowadzenia do bezradności); „policja” (przy użyciu chemikaliów i trucizn w celu przywrócenia porządku publicznego) oraz zwalczanie zatruć (przy użyciu broni chemicznej), w tym w wyniku aktów terrorystycznych. W zależności od liczby ofiar rozróżnia się ostre zatrucia indywidualne, grupowe i masowe. Przyjmowanie substancji toksycznej jest możliwe przez usta (wbudowane, doustne), przez drogi oddechowe (wdychanie), przez nieosłoniętą skórę (przezskórnie), przez wstrzyknięcie pozajelitowe lub po wstrzyknięciu do odbytnicy, pochwy, zewnętrznego przewodu słuchowego. W przebiegu klinicznym ostrego zatrucia wyróżnia się dwa etapy: toksykogenny i somatogenny. Istotą etapu toksycznego jest to, że substancja czynna w organizmie ma dawkę, która może wywołać określony efekt toksyczny. Etap somatogenny występuje po wyeliminowaniu lub zniszczeniu substancji toksycznej i objawia się w postaci „śladów” lub szczątkowych naruszeń stanu strukturalnego i funkcjonalnego narządów i układów. Ogólne zasady diagnozowania ostrego zatrucia 1. Diagnoza kliniczna opiera się na następujących danych: 1) oględziny miejsca zdarzenia w celu wykrycia materialnych dowodów zatrucia; 2) anamneza ze słów ofiary lub innych - można dowiedzieć się, jaką substancję toksyczną zażyła ofiara, czas przyjęcia substancji toksycznej, dawka pobranej substancji toksycznej, droga wnikania substancji toksycznej do organizmu , okoliczności towarzyszące rozwojowi zatrucia itp .; 3) badanie obrazu klinicznego choroby w celu zidentyfikowania specyficznych objawów zatrucia charakterystycznych dla określonej substancji toksycznej lub grupy substancji zgodnie z zasadą „toksyczności selektywnej”. 2. Laboratoryjna diagnostyka toksykologiczna ma na celu jakościowe lub ilościowe oznaczenie substancji toksycznych w ośrodkach biologicznych organizmu (krew, mocz itp.). 3. Diagnostyka patologiczna polega na wykryciu określonych pośmiertnych objawów zatrucia i jest przeprowadzana przez biegłych sądowych. 1. Zatrucie alkoholem metylowym Alkohol metylowy jest wchłaniany wszystkimi drogami – oddechową, pokarmową i przezskórną. Śmiertelna dawka metanolu przy przyjmowaniu doustnym waha się w granicach 40-250 ml, ale zażywanie nawet 10-20 ml może spowodować ślepotę. Zatrucie występuje również po spożyciu różnych mieszanin alkoholowych zawierających od 1,5 do 2,5% metanolu. Po wchłonięciu metanol jest rozprowadzany we wszystkich tkankach dzięki rozpuszczalności w wodzie. Najwięcej kumuluje się w nerkach i przewodzie pokarmowym, najmniej w mózgu, mięśniach i tkance tłuszczowej. Do patologicznych zmian anatomicznych zalicza się obrzęk mózgu oraz uszkodzenie początkowo zapalnego, a później dystroficznego charakteru komórek zwojowych siatkówki. W niektórych przypadkach oprócz uszkodzenia układu nerwowego stwierdza się zmiany zwyrodnieniowe wątroby, nerek, płuc i mięśnia sercowego. Obraz kliniczny W toksycznym działaniu metanolu można wyróżnić działanie dwufazowe. W początkowym okresie (faza I) metanol działa na organizm jako cała cząsteczka i ma głównie działanie narkotyczne, ale słabsze niż alkohol etylowy. Następnie (faza II) objawia się szkodliwy wpływ produktów utleniania. W obrazie klinicznym rozróżnia się okresy: zatrucie, utajone lub względne samopoczucie (trwające od kilku godzin do 1-2 dni), główne objawy zatrucia i, przy korzystnym wyniku, odwrotny rozwój. W zależności od nasilenia rozróżnia się łagodny, umiarkowany (lub okulistyczny) i ciężki (lub uogólniony). Przy łagodnym zatruciu obserwuje się szybkie zmęczenie, ból głowy, nudności i stan lekkiego zatrucia, które występują po okresie utajonym od 30 minut do kilku godzin. Jednoczesne wchłanianie alkoholu etylowego i metylowego wydłuża okres utajony i zmniejsza nasilenie zatrucia. W przypadku umiarkowanego zatrucia, po krótkim okresie utajonym u pacjenta pojawia się ból głowy, zawroty głowy, ostry ból brzucha (głównie w okolicy nadbrzusza), wymioty, niepokój, majaczenie, drgawki. W końcu pojawia się głęboka śpiączka. Pacjent ma hipotermię, w niektórych przypadkach sinicę, gdy rozwija się niewydolność oddechowa o charakterze ośrodkowym, a następnie niewydolność sercowo-naczyniowa. Na tym etapie źrenice rozszerzają się, a badanie dna oka wskazuje na obecność obrzęku siatkówki. Charakterystyczne zaburzenia widzenia, takie jak obniżona ostrość widzenia, zwężenie pola widzenia, rozszerzenie źrenic, utrata odruchów na światło, ból gałki ocznej pojawiają się w 2-6 dobie. Badanie dna oka ujawnia oznaki zaniku nerwu wzrokowego. Najpoważniejszą komplikacją jest całkowita ślepota. Leczenie Leczenie obejmuje następujące punkty. 1. Zatrzymanie wnikania trucizny do organizmu. Zaprzestanie używania trucizny, usunięcie ze skażonej atmosfery, usunięcie trucizny ze skóry. 2. Usunięcie niewchłoniętej trucizny (z przewodu pokarmowego): 1) sonda do płukania żołądka; 2) stosowanie adsorbentów lub solankowych środków przeczyszczających; 3) oczyszczanie lub lewatywa syfonowa. 3. Usunięcie wchłoniętej trucizny: 1) wymuszanie diurezy; 2) metody detoksykacji pozaustrojowej (hemosorpcja, hemodializa, dializa otrzewnowa, operacja wymiany krwi). 4. Terapia antidotum, czyli neutralizacja trucizny poprzez neutralizację fizyczną lub chemiczną, a także rywalizację z trucizną o punkty podania. 6. Utrzymanie funkcji życiowych organizmu. 7. Normalizacja stanu wodno-elektrolitowego, kwasowo-zasadowego organizmu. 8. Leczenie odległych następstw i powikłań. Płukanie żołądka wodą lub 2% roztworem wodorowęglanu sodu, a następnie spożycie 30 g siarczanu magnezu (sodu) w 100 ml wody. Podskórnie 2 ml kordiaminy, 1 ml 20% roztworu kofeiny. W śpiączce dożylnie 5% roztwór alkoholu etylowego w 5% roztworze glukozy w ilości 1,5-2 g alkoholu na 1 kg masy ciała pacjenta na dzień. Dożylnie 400 ml poliglucyny (reopolyglucyny), 50-100 mg prednizolonu, mieszaniny glukozon-wokaina (400 ml 5% roztworu glukozy z 25 ml 2% roztworu nowokainy), 80-120 mg furosemidu (lasix), 40 ml 40% - roztwór glukozy z 8 jm insuliny. 2. Zatrucie alkoholem etylowym Klinika Podczas przyjmowania dawek toksycznych - pobudzenie, ataksja, otępienie, śpiączka z zahamowaniem odruchów, zapach alkoholu z ust, zaczerwienienie twarzy, zapalenie spojówek, "gra" źrenic, wymioty, mimowolne oddawanie moczu, tachykardia, "chrypka" oddychanie , zapaść, wymioty z możliwością aspiracji wymiotów wt. Leczenie Płukanie żołądka przez grubą sondę, a następnie wprowadzenie środka przeczyszczającego z solą fizjologiczną, lewatywa syfonowa. Podskórnie 1 ml 0,1% roztworu atropiny, 2 ml kordiaminy, 1 ml 20% roztworu kofeiny, z zapaścią - domięśniowo 1 ml 1% roztworu mezatonu. W przypadku braku odruchów gardłowych - intubacja tchawicy i wentylacja mechaniczna. Wymuszanie diurezy z jednoczesnym podaniem 4% roztworu wodorowęglanu sodu w objętości obliczonej według wzoru Astrup, hipertoniczne (10- i 20%) roztwory glukozy z insuliną, witaminami B i C, kokarboksylazą, kwasem nikotynowym. Z depresją oddechową - powoli dożylnie 3-5 ml 1,5% roztworu etimizolu, 10 ml 2,4% roztworu aminofiliny, 1 ml 5% roztworu efedryny, inhalacja tlenem. Z aspiracją - awaryjna bronchoskopia sanitarna. Antybiotyki pozajelitowe. 3. Zatrucie glikolem etylenowym (przeciw zamarzaniu) Średnia dawka śmiertelna wynosi około 100 ml. Jest szybko wchłaniany w przewodzie pokarmowym i rozprowadzany do wszystkich tkanek, tworząc maksymalne stężenie w mózgu. Główny efekt toksyczny obserwuje się w miąższu nerek, gdzie rozwija się martwica nabłonka kanalików, obrzęk śródmiąższowy i ogniska martwicy krwotocznej w warstwie korowej. Obrzęk znajduje się w mózgu. Klinika W klinice zatrucia rozróżnia się 3 okresy: 1) początkowe – trwające do 12 godzin, przeważają objawy uszkodzenia OUN ze względu na rodzaj zatrucia alkoholowego; 2) neurotoksyczne – gdy łączą się objawy postępu uszkodzenia OUN oraz zaburzeń układu oddechowego i sercowo-naczyniowego; 3) nefrotoksyczne - w 2-5 dniu dominuje uszkodzenie nerek w obrazie klinicznym zatrucia. Czas trwania i nasilenie okresów zatrucia zależy od ciężkości zatrucia. W łagodnych przypadkach, po okresie zatrucia (10-15 godzin), pojawia się lekkie złe samopoczucie, ból głowy i nudności. Świadomość pozostaje jasna, nie obserwuje się uszkodzenia nerek. Przy umiarkowanym zatruciu na tle objawów zatrucia występują wymioty, biegunka, ból w nadbrzuszu i ból głowy. W 3-5 dniu pojawiają się objawy uszkodzenia nerek. W ciężkim zatruciu szybko następuje utrata przytomności, sztywność karku, drgawki kloniczno-toniczne, gorączka, głośny, głęboki oddech, zapaść i obrzęk płuc. Jeśli pacjent nie umiera w pierwszym dniu, to od 2-3 dnia rozwijają się objawy niewydolności nerek: pojawia się pragnienie, ból pleców, zmniejsza się ilość moczu, aż do bezmoczu. Wątroba jest powiększona, bolesna. Śmierć pochodzi z mocznicy. Leczenie Płukanie żołądka wodą lub 2% roztworem wodorowęglanu sodu, a następnie wprowadzenie 30 g siarczanu magnezu do 200 ml wody. Wewnątrz 200 ml 30% roztworu alkoholu etylowego. 3-5 g wodorowęglanu sodu w 100 ml wody. Obfity napój. Domięśniowo 1-2 ml kordiaminy, 1 ml 20% roztworu kofeiny. Dożylnie 400 ml 5% roztworu glukozy z 5 ml 5% roztworu kwasu askorbinowego i 8 jednostkami insuliny, mieszanina glukozon-wokaina, 400 ml poliglucyny, 400 ml hemodezu, 80-120 g furosemidu, 60-100 mg prednizolon. 4. Zatrucie dichloroetanem Główne drogi wejścia to przewód pokarmowy, drogi oddechowe i skóra. Śmiertelna dawka DCE dla ludzi po podaniu doustnym wynosi 10-20 ml. Toksyczne działanie DCE wynika z działania narkotycznego na ośrodkowy układ nerwowy, uszkodzenia wątroby, nerek, przewodu pokarmowego i wyraźnego wpływu na układ sercowo-naczyniowy. Klinika W obrazie klinicznym wiodącymi objawami są: toksyczna encefalopatia, ostre toksyczne zapalenie żołądka i żołądka i jelit, upośledzenie oddychania zewnętrznego, toksyczne zapalenie wątroby, upośledzona czynność nerek. W pierwszych godzinach po podaniu pojawiają się zawroty głowy, ataksja, pobudzenie psychomotoryczne, drgawki kloniczno-toniczne, depresja świadomości, aż do śpiączki. Jednym z wczesnych objawów zatrucia są zaburzenia żołądkowo-jelitowe w postaci nudności, powtarzające się wymioty z domieszką żółci. Naruszenie funkcji oddychania zewnętrznego często występuje zgodnie z typem obturacji i aspiracji i wiąże się ze zwiększonym wydzielaniem śliny, krwotokiem oskrzelowym i aspiracją. Obserwuje się hamowanie funkcji ośrodka oddechowego, rozwój hipertoniczności mięśni oddechowych i sztywność klatki piersiowej. Poważnym powikłaniem jest wstrząs egzotoksyczny, który objawia się ochłodzeniem i sinicą skóry, zimnym potem, dusznością, tachykardią i hipowolemią. Zmniejszona funkcja wydalnicza nerek. W zależności od ciężkości zatrucia DCE dzieli się na następujące. 1. Łagodne zatrucie, charakteryzujące się rozwojem zaburzeń dyspeptycznych, łagodnymi objawami neurologicznymi i łagodną hepatopatią. 2. Umiarkowane zatrucie. Występują z objawami toksycznego zapalenia żołądka, zapalenia żołądka i jelit, toksycznej encefalopatii, umiarkowanej hepatopatii, łagodnej nefropatii. 3. Ciężkie zatrucie występuje z ciężkimi objawami toksycznej encefalopatii, ciężkiej hepatopatii, toksycznej nefropatii, zapalenia żołądka i jelit. W przypadku zatrucia parą, ból głowy, senność, słodkawy smak w ustach, zapach trucizny z ust, podrażnienie błon śluzowych, utrata przytomności, ostra niewydolność wątrobowo-nerkowa z zażółceniem twardówki i skóry, powiększenie wątroby , pojawia się bezmocz. Po spożyciu - powtarzające się wymioty, bóle brzucha, luźne stolce z zapachem trucizny, przekrwienie twardówki, pobudzenie psychoruchowe, a następnie depresja i śpiączka, zapaść, wstrząs toksyczny, zespół krwotoczny, ostra niewydolność wątrobowo-nerkowa. Kiedy trucizna dostanie się na skórę, rozwija się zapalenie skóry. Leczenie W przypadku zatrucia oparami - usunięcie ofiary z dotkniętego obszaru, z depresją oddechową IVL. Jeśli trucizna dostanie się do środka - płukanie żołądka przez grubą sondę, a następnie wprowadzenie 3-4 łyżek sproszkowanego węgla aktywnego w 200 ml wody i 150-200 ml oleju wazelinowego, lewatywa syfonowa. Dożylnie 20-40 ml 30% roztworu tiosiarczanu sodu, domięśniowo 5 ml 5% roztworu unitiolu. dożylnie 400 ml poliglucyny, 400 ml hemodezu, 400 ml 5% roztworu glukozy, 80-120 mg furosemidu (lasix), 6-8 ml 5% roztworu kwasu askorbinowego. Domięśniowo 2 ml kordiaminy, z zapaścią - 1 ml 1% roztworu mezatonu, 1 ml 20% roztworu kofeiny, 100-150 mg prednizolonu. Wraz ze wzrostem niewydolności wątrobowo-nerkowej przeprowadza się swoistą terapię. Dożylnie bolus 400 ml poliglucyny, 400 ml gemodezu, 400 ml 5% glukozy, 80-120 mg furosemidu, 6-8 ml 5% kwasu askorbinowego, 100-150 mg prednizolonu, z załamaniem 1 ml 1% mezaton . Domięśniowo 2-4 ml 6% bromku tiaminy i 2-4 ml 5% pirydoksyny. Z pobudzeniem psychomotorycznym 1 ml 3% roztworu fenozepamu. Inhalacja tlenowa, z depresją oddechową - IVL przez rurkę oddechową. W pierwszym dniu najskuteczniejszą i najoszczędniejszą metodą jest dializa otrzewnowa. W skład standardowego roztworu do dializy wchodzą: chlorek potasu 0,3 g, chlorek sodu 8,3 g, chlorek magnezu 0,1 g, chlorek wapnia 0,3 g, glukoza 6 g na 1 litr wody. Jednocześnie do jamy brzusznej pacjenta wstrzykuje się do 2 litrów roztworu elektrolitu z dodatkiem 500 tysięcy jednostek penicyliny i 1000 jednostek heparyny. W somatogennej fazie zatrucia główna terapia ma na celu leczenie rozwiniętych powikłań: zapalenia płuc, hepatopatii itp. 5. Zatrucie trującymi grzybami (muchomor, fałszywe grzyby, smardze, blady perkoz) Klinika Po okresie utajonym trwającym od 1-2 do 36 godzin pojawiają się skurczowe bóle brzucha, ślinotok, nudności, nieugięte wymioty, biegunka, odwodnienie, zapaść, majaczenie, omamy, drgawki. W 2-3 dniu - zjawiska niewydolności nerek i wątroby z bezmoczem, azotemią, żółtaczką. W ciężkim zatruciu liniami i smardzami możliwa jest hemoliza. Leczenie Płukanie żołądka przez grubą sondę, a następnie wprowadzenie 3-4 łyżek sproszkowanego węgla aktywnego w 200 ml wody i 30 g siarczanu magnezu (sodu) w 100 ml wody, lewatywa syfonowa. Podskórnie 1 ml 0,1% roztworu atropiny, 2 ml kordiaminy. W zatruciu smardzami atropina nie jest stosowana jako antidotum. Dożylnie 400 ml poliglucyny, 400 ml gemodezu, 400 ml 5% roztworu glukozy z 4-6 ml 5% roztworu kwasu askorbinowego, 80-120 mg furosemidu (lasix). Domięśniowo 1-2 ml 6% roztworu bromku tiaminy i 2 ml 5% roztworu chlorowodorku pirydoksyny (nie wstrzykiwać w jednej strzykawce). Złagodzenie zespołu bólowego domięśniowo po wprowadzeniu 1 ml 0,2% roztworu platifillin, 2 ml 2% roztworu papaweryny. Z drgawkami, pobudzenie psychoruchowe - domięśniowo 1-2 ml 3% roztworu fenozepamu lub mieszaniny litycznej (1-2 ml 2,5% roztworu chloropromazyny, 1-2 ml 1% roztworu dimedrolu, 5-10 ml 25% roztwór siarczanu magnezu) pod kontrolą ciśnienia krwi. Wymuszanie diurezy. W ciężkich przypadkach - hemosorpcja, wczesna hemodializa. W przypadku ciężkiego zatrucia sznurkami i smardzami, w przypadku ciężkiej hemolizy i braku możliwości hemodializy przeprowadza się operację wymiany krwi. Korekta kwasicy poprzez dożylne podanie 4% roztworu wodorowęglanu sodu w objętości określonej według wzoru Astrupa. Antybiotyki - benzylopenicylina do 10 milionów jednostek dziennie. Terapia objawowa. Przy narastającej niewydolności wątroby i nerek - terapia infuzyjna 5-10% roztworem glukozy z insuliną, witaminami B i C, 20-30 tysięcy jm heparyny, aminofiliny. 6. Zatrucie jadem węża Klinika Ból i szybko rozprzestrzeniający się obrzęk w miejscu ukąszenia, senność, depresja oddechowa, zapaść, hemoliza wewnątrznaczyniowa z hemoglobinurią, ciężkie krwotoki podskórne, czasami drgawki. Prawdopodobnie niewydolność nerek. W przypadku ukąszenia kobry zmiany miejscowe są mniej wyraźne, przeważają zaburzenia opuszkowe (zaburzenia mowy i połykania, opadanie powiek, paraliż mięśni ruchowych) i depresja oddechowa. Pokazuje całkowity odpoczynek w pozycji poziomej. Wyciskanie pierwszych kropli krwi z rany. Unieruchomienie uszkodzonej kończyny. W miejscu ugryzienia - zimno. Obfity napój. Leczenie Zasysanie krwi i limfy z rany (nie później niż 30-60 minut po ugryzieniu), utworzone w miejscu ugryzienia, za pomocą słoja ssącego krew. Przemycie rany 1% roztworem nadmanganianu potasu. Wprowadzenie do rany 0,3-0,5 ml 0,1% roztworu adrenaliny. Jeśli to możliwe, pilne wprowadzenie specyficznej mono- lub poliwalentnej surowicy przeciwwężowej po wstępnym wstrzyknięciu dożylnym 100-150 ml hydrokortyzonu lub 50-100 ml prednizolonu. W przypadku ukąszeń kobry - dożylnie surowica Anticobra w dawce 300 ml w połączeniu z 1 ml 0,05% roztworu prozerinu i wielokrotne podawanie co 30 minut z 1 ml 0,1% roztworu atropiny. Profilaktycznie - serum przeciwtężcowe wg Bezredki, dożylna mieszanina polaryzacyjna, 10-15 tys. j. heparyny, 1-2 ml 1% roztworu difenhydraminy, 10 ml 10% roztworu chlorku wapnia (glukonianu), 5-10 ml 5 % - roztwór kwasu askorbinowego, 50-100 mg prednizolonu lub 100-150 mg hydrokortyzonu, 400 ml gemodezu, 400 ml poliglucyny, 40-80 mg lasix. Uśmierzenie bólu przez dożylne podanie 1 ml 2% roztworu promedolu. W ostrej niewydolności oddechowej - wentylacja mechaniczna przez rurkę oddechową, inhalacja tlenem. W ciężkiej toksykozie - hemosorpcja, z postępem niewydolności wątrobowo-nerkowej - hemodializa w połączeniu z hemosorpcją. Terapia objawowa. 7. Zatrucie stężonymi kwasami (azotowym, octowym, siarkowym) Klinika Wdychanie oparów powoduje podrażnienie oczu i górnych dróg oddechowych (łzawienie, katar, kaszel, duszność). Możliwe jest odruchowe zatrzymanie oddechu. Po okresie utajonym (od 2 do 24 godzin) powstaje toksyczne zapalenie płuc lub toksyczny obrzęk płuc. Przy uderzeniu w oczy, na skórę - oparzenia chemiczne. Po spożyciu - chemiczne oparzenie jamy ustnej, gardła, przełyku, żołądka, możliwy obrzęk krtani z niewydolnością oddechową. Powtarzające się krwawe wymioty, podrażnienie otrzewnej, a czasami perforacja przełyku lub żołądka. Zapaść, wstrząs, zespół krwotoczny. Możliwa hemoliza wewnątrznaczyniowa, nerczyca hemoglobinuriowa z ostrą niewydolnością nerek (nerkowo-wątrobową). Płukanie żołądka bezdętkowe i sztuczne wymioty są niebezpieczne ze względu na możliwość ponownego poparzenia przełyku i aspiracji kwasu. Nie wstrzykiwać solnych roztworów przeczyszczających i zasadowych. Leczenie Płukanie żołądka przez grubą rurkę zimną wodą po wstępnym wstrzyknięciu dożylnym lub domięśniowym 1-2 ml 2% roztworu promedolu. Wewnątrz kawałków lodu Almagel A 15-20 ml co godzinę. Dożylnie 800 ml poliglucyny, 400 ml hemodezu, mieszaniny glukozon-wokaina (400 ml 5% roztworu glukozy z 25 ml 2% roztworu nowokainy), 50-150 mg prednizolonu lub 150-250 mg hydrokortyzonu, 10 tysięcy jednostek heparyny, 80-120 mg furosemidu (Lasix). Złagodzenie zespołu bólowego osiąga się dożylnie przez wprowadzenie 1-2 ml 0,005% roztworu fentanylu i 2-4 ml 0,25% roztworu droperydolu, z uporczywym bólem brzucha - domięśniowo 1-2 ml 0,2% roztwór platyfillin, 2 ml 2% roztworu papaweryny. Wdychanie tlenu z odpieniaczem. Wraz ze wzrostem obrzęku krtani - dożylnie 200-400 mg prednizolonu, 1-2 ml 1% roztworu difenhydraminy, 10-20 ml 2,4% roztworu aminofiliny, 1-2 ml 5% roztworu efedryny. W przypadku braku efektu - tracheostomia, inhalacja tlenem, zgodnie ze wskazaniami - wentylacja mechaniczna. 8. Zatrucie arsenem i jego związkami Klinika W ustach metaliczny posmak, ból brzucha, wymioty, luźne stolce, silne odwodnienie, drgawki, tachykardia, obniżenie ciśnienia krwi, śpiączka, ostra niewydolność nerek. Zatrucie wodorem arsenem rozwija hemolizę wewnątrznaczyniową, hemoglobinurię. Leczenie Płukanie żołądka grubą sondą (2-3 razy dziennie) z wprowadzeniem na początku i na końcu płukania 50 ml 5% roztworu unithiolu, powtarzane lewatywy syfonowe z dodatkiem unithiolu. Kontynuacja terapii antidotum dożylnie lub domięśniowo z wprowadzeniem 5% roztworu unitiolu (do 300 ml dziennie), kroplówka dożylna 20 ml 10% tetacyny wapnia (ED1A) w 400 ml 5% roztworu glukozy. W przypadku zatrucia wodorem arsenu - domięśniowo 1-2 ml 40% roztworu mekaptydu (do 6-8 ml dziennie). Wymuszanie diurezy z jednoczesnym podaniem hipertonicznych (10-20% roztwór glukozy) roztworów polijonowych, 4% roztwór wodorowęglanu sodu w objętości obliczonej według wzoru Astrup, mieszanina glukozon-wokaina, aminofilina, witaminy z grupy B i C, cytochrom C. W ciężkim zatruciu - wczesna hemodializa. W trakcie wykonywania hemodializy dożylnie wstrzykuje się 5% roztwór unitiolu (30-40 ml / h w przypadku ciężkiego zatrucia, 20-30 ml / h w przypadku umiarkowanego zatrucia). W ostrej hemolizie i niemożności hemodializy wykonuje się operację wymiany krwi. 9. Zatrucie ługiem Klinika Po spożyciu rozwija się chemiczne oparzenie błony śluzowej jamy ustnej, przełyku i żołądka. Ból wzdłuż przełyku i brzucha, wymioty z domieszką krwi, krwawienie z przełyku i żołądka. Możliwa perforacja przełyku, żołądka z rozwojem zapalenia śródpiersia, zapalenie otrzewnej. Z oparzeniem krtani - chrypka głosu, bezgłos, trudności w oddychaniu (stridor). W ciężkich przypadkach - wstrząs oparzeniowy, skąpomocz. Kontakt ze skórą powoduje oparzenia chemiczne. Leczenie Traktuj jak w przypadku zatrucia kwasem. 10. Zatrucie atropiną Klinika Suchość w ustach, chrypka, suchość, przekrwienie skóry, rozszerzone źrenice, duszność, kołatanie serca, tachykardia, pragnienie, nudności, trudności w oddawaniu moczu. W ciężkim zatruciu - możliwe jest pobudzenie psychoruchowe, majaczenie, halucynacje, drgawki, zaburzenia rytmu serca, śpiączka, zapaść. Leczenie W razie potrzeby - płukanie żołądka przez grubą sondę, bogato nasmarowaną olejem wazelinowym, wprowadzenie 3-4 łyżek. l. sproszkowany węgiel aktywny w 200 ml wody i 30 mg siarczanu magnezu w 100 ml wody. dożylnie 2-4 ml 0,05% roztworu proseryny, 400-800 ml 5% roztworu glukozy, 40-80 mg furosemidu (lasix). Obfity napój. Złagodzenie pobudzenia psychoruchowego i drgawek domięśniowo po wprowadzeniu 1-2 ml 3% roztworu fenozepamu lub mieszaniny litycznej (2 ml 2,5% roztworu chloropromazyny, 2 ml 1% roztworu difenhydraminy i 10 ml 25% roztwór siarczanu magnezu lub 1-2 g wodzianu chloralu w lewatywie z 1-2 g skrobi na 25-50 ml wody, dożylnie 10-15 ml 20% roztworu hydroksymaślanu sodu, 2-4 ml 0,5% roztworu seduxenu. W przypadku ciężkiej tachykardii, ekstrasystoli - dożylnie anaprilin (1-2 ml 0,25% roztworu) lub tabletka anaprilin (40 mg) pod językiem. Z zapaścią - dożylnie 1 ml 1% roztworu mezatonu w 10 ml 0,9% roztworu chlorku sodu. Z ostrą hipertermią - domięśniowo 2 ml 50% roztworu analgezji, okłady lodowe na dużych naczyniach i głowie, mokre okłady. 11. Zatrucie konopiami (haszysz, marihuana, marihuana, plan) Klinika Występuje euforia, pobudzenie psychoruchowe, żywe halucynacje wzrokowe, rozszerzone źrenice, szum w uszach. Następnie osłabienie, letarg, obniżenie nastroju, senność, bradykardia, hipotermia. Leczenie W przypadku zatrucia doustnego - płukanie żołądka przez grubą rurkę, a następnie wprowadzenie 3-4 łyżek sproszkowanego węgla aktywnego w 200 ml wody. Dożylnie 400-800 ml 5% roztworu glukozy z 5-10 ml 5% roztworu kwasu askorbinowego i 8-16 jednostek insuliny, 40-80 mg furosemidu (lasix), domięśniowo 2 ml 6% roztworu bromku tiaminy. Z ostrym pobudzeniem - domięśniowo 3-5 ml 2,5% roztworu chloropromazyny lub mieszaniny litycznej (2 ml 2,5% roztworu chloropromazyny, 1-2 ml 1% roztworu difenhydraminy i 5-10 ml 25 % - roztwór siarczanu magnezu) pod kontrolą ciśnienia krwi. wdychanie tlenu. Wymuszanie diurezy. W ciężkich przypadkach uciekaj się do hemosorpcji. 12. Zatrucie kokainą i dikainą Klinika Klinicznie objawia się ogólnym pobudzeniem, bólem głowy, zaczerwienieniem twarzy, rozszerzonymi źrenicami, tachykardią, przyspieszonym oddychaniem, podwyższonym ciśnieniem krwi, omamami. W ciężkich przypadkach - drgawki, śpiączka, porażenie oddechowe, zapaść. Leczenie Powtarzane płukanie żołądka przez grubą sondę 0,1% roztworem nadmanganianu potasu, a następnie wprowadzenie 3-4 łyżek. l. sproszkowany węgiel aktywny w 200 ml wody i 30 g siarczanu magnezu w 100 ml wody. Dożylnie 400 ml gemodezu, 400 ml 5% roztworu glukozy z 5-10 ml 5% roztworu kwasu askorbinowego, 40-80 mg furosemidu (lasix). Podekscytowany - unieruchomienie ofiary domięśniowo 1-2 ml 3% roztworu fenozepamu lub mieszaniny litycznej (1-2 ml 2,5% roztworu chloropromazyny, 2 ml 1% roztworu difenhydraminy i 5-10 ml 25% - roztwór siarczanu magnezu) pod kontrolą ciśnienia krwi. W przypadku drgawek podaje się do lewatywy 1-2 g wodzianu chloralu z 1-2 g skrobi w 25-50 ml wody, dożylnie powoli 15-20 ml 20% roztworu hydroksymaślanu sodu, jeśli nie ma efektu, powoli domięśniowo do 20 ml 2,5% roztworu tiopentalu sodu lub heksenalu. Wraz z rozwojem śpiączki - okład z lodu na głowie dożylnie 40 ml 40% roztworu glukozy z 4-6 ml 5% roztworu kwasu askorbinowego i 8 jednostek insuliny, dożylnie powoli lub domięśniowo 2-4 ml 6% roztworu bromku tiaminy i 2-4 ml 5% roztworu chlorowodorku pirydoksyny, 80-120 mg furosemidu. Przy ciężkiej depresji oddechowej przeprowadza się wentylację mechaniczną, dożylnie powoli 2 ml kordiaminy, wdychanie tlenu. 13. Zatrucie narkotycznymi lekami przeciwbólowymi (morfina, omnopon, droperydol) Klinika Senność lub utrata przytomności, zwężenie źrenic, hipertoniczność mięśni (czasem drgawki), depresja oddechowa, bradykardia, zapaść. Porażenie oddechowe jest możliwe przy zachowanej świadomości pacjenta. Leczenie Płukanie żołądka przez grubą sondę (przy zachowaniu świadomości), a następnie wprowadzenie 3-4 łyżek sproszkowanego węgla aktywnego i 30 g siarczanu sodu, lewatywa syfonowa. Dożylnie 400 ml gemodezu, 400 ml poliglucyny, 400 ml 5% roztworu glukozy, 60-80 mg furosemidu (lasix). Podskórnie 1-2 ml 0,1% roztworu atropiny, 1-2 ml kordiaminy, 1 ml 20% roztworu kofeiny. Wraz z rozwojem śpiączki, okład z lodu na głowie dożylnie 40 ml 40% roztworu glukozy z 5-10 ml 5% roztworu kwasu askorbinowego i 8 jednostek insuliny, dożylnie powoli lub domięśniowo 2-4 ml 6% roztworu bromku tiaminy i 2-4 ml 5% roztworu chlorowodorku pirydoksyny, 80-120 mg furosemidu (lasix). W razie potrzeby - cewnikowanie pęcherza i ekstrakcja moczu. Z depresją oddechową - IVL, wdychanie tlenu. Hemosorpcja (2-3 razy dziennie do przywrócenia świadomości). Wykład nr 11. Ból i leki przeciwbólowe 1. Ból Ból jest nieprzyjemnym stanem czuciowym i emocjonalnym spowodowanym rzeczywistym lub potencjalnym patologicznym wpływem na tkanki. W OUN ból jest prowadzony dwiema głównymi drogami. Specyficzna ścieżka - tylne rogi rdzenia kręgowego, specyficzne jądra wzgórza, kora tylnego centralnego zakrętu. Droga ta jest niskoneuronalna, szybka, prowadzi ból progowy, emocjonalnie bezbarwny, precyzyjnie zlokalizowany (ból epikrytyczny). Niespecyficzny sposób - tylne rogi rdzenia kręgowego, niespecyficzne jądra wzgórza, kora płatów czołowych i ciemieniowych rozproszona. Prowadzi podprogowy, zabarwiony emocjonalnie, słabo zlokalizowany ból. Jest powolny, wieloneuronalny, ponieważ tworzy liczne elementy przyległe do rdzenia przedłużonego, tworu siatkowatego, układu limbicznego i hipokampu. Podprogowe impulsy bólowe sumują się we wzgórzu. Impulsy prowadzone wzdłuż niespecyficznej drogi bólu pobudzają emocjonalne ośrodki układu limbicznego, autonomiczne ośrodki podwzgórza i rdzeń przedłużony. Dlatego bólowi towarzyszy strach, bolesne doświadczenia, wzmożony oddech, puls, wzrost ciśnienia krwi, rozszerzenie źrenic, zaburzenia dyspeptyczne. Działaniu systemu bólu nocyceptywnego przeciwdziała system antynoceceptywny, którego główne neurony zlokalizowane są w okołowodoprzewodowej istocie szarej (akwedukt Sylviusa łączy komorę III i IV). Ich aksony tworzą ścieżki zstępujące do rdzenia przedłużonego i rdzenia kręgowego oraz ścieżki wstępujące do formacji siatkowatej, wzgórza, podwzgórza, układu limbicznego, zwojów podstawy mózgu i kory. Mediatorami tych neuronów są pentapeptydy: metenkefalina i leuenkefalina, które mają odpowiednio metioninę i leucynę jako końcowe aminokwasy. Enkefaliny pobudzają receptory opiatowe. W synapsach enkefalinergicznych receptory opiatowe znajdują się na błonie postsynaptycznej, ale ta sama błona jest presynaptyczna dla innych synaps. Receptory opiatowe są związane z cyklazą adenylanową i powodują jej hamowanie poprzez zaburzenie syntezy cAMP w neuronach. W efekcie zmniejsza się napływ wapnia i uwalnianie mediatorów, w tym mediatorów bólu - peptydów: substancji P, cholecystokininy, somatostatyny, kwasu glutaminowego. Receptory opiatowe pobudzane są nie tylko przez mediatory – enkefaliny, ale także przez inne składniki układu antynocepcyjnego – hormony mózgowe (endorfiny). Agoniści peptydowi receptorów opiatowych powstają podczas proteolizy substancji peptydowych mózgu: proopiokortyny, proenkefalin A i B. Wszystkie te peptydy powstają w podwzgórzu. Receptory opiatów pobudzają receptory we wszystkich strukturach mózgu biorących udział w przewodzeniu i odczuwaniu bólu, tworząc emocjonalnie zabarwione reakcje na ból. Jednocześnie zmniejsza się uwalnianie mediatorów bólu, a wszystkie reakcje towarzyszące bólowi ulegają osłabieniu. 2. Leki przeciwbólowe Lek przeciwbólowy (kwas acetylosalicylowy, paracetamol, morfina) to lek zmniejszający ból różnego pochodzenia. Do klasycznych leków przeciwbólowych nie należą leki, które zmniejszają ból wywołany tylko przez pewien czynnik sprawczy lub eliminują określony zespół bólowy, na przykład leki zobojętniające sok żołądkowy, ergotamina (migrena), karbamazepina (neuralgia), nitrogliceryna (dławica piersiowa). Kortykosteroidy hamują odpowiedź zapalną i wynikający z niej ból, ale pomimo ich powszechnego stosowania do tych celów, nie stanowią również klasycznych środków przeciwbólowych. Leki przeciwbólowe dzielą się na narkotyczne, działające na struktury ośrodkowego układu nerwowego i powodujące senność, takie jak opioidy, oraz nienarkotyczne, działające głównie na struktury obwodowe, takie jak paracetamol, kwas acetylosalicylowy. Dodatkowe leki wzmacniające działanie leków przeciwbólowych Leki z tej grupy same w sobie nie są lekami przeciwbólowymi, lecz są stosowane w połączeniu z lekami przeciwbólowymi, gdyż mogą zmienić nastawienie do bólu, jego percepcję i poziom lęku, lęku, depresji (trójpierścieniowe leki przeciwdepresyjne mogą nawet powodować zmniejszenie zapotrzebowania na morfina u pacjenta w stanie terminalnym). Takimi lekami mogą być leki psychotropowe, a także te, które wpływają na mechanizmy bólu, np. likwidując skurcze mięśni gładkich i prążkowanych. Narkotyczne środki przeciwbólowe to leki ziołowe i syntetyczne, które selektywnie zmniejszają odczuwanie bólu, zwiększają tolerancję bólu poprzez zmniejszenie emocjonalnego zabarwienia bólu i jego wegetatywnego akompaniamentu, wywołują euforię i uzależnienie od narkotyków. Narkotyczne środki przeciwbólowe zmniejszają przewodzenie i odczuwanie bólu tylko w granicach ośrodkowego układu nerwowego, tłumiąc głównie szlak niespecyficzny. Środki z tej grupy pobudzają receptory opiatowe, działają podobnie do działania peptydów układu anty-noreceptywnego. Dlatego główne mechanizmy znieczulenia to: zaburzenie przewodzenia impulsu bólowego z aksonu neuronu I, którego ciało znajduje się w zwoju kręgowym, do neuronu II, zlokalizowanego w galaretowatej substancji rogów tylnych rdzeń kręgowy. Tłumienie sumowania impulsów podprogowych we wzgórzu. Zmniejszony udział w reakcji bólowej rdzenia przedłużonego, podwzgórza, układu limbicznego (nieakcentowany stosunek do bólu). Klasyfikacja narkotycznych leków przeciwbólowych i ich antagonistów Klasyfikacja jest następująca. 1. Pochodne piperydyno-fenantrenu: 1) morfina; 2) kodeina (metylomorfina, 5-7 razy słabsza od morfiny jako środek przeciwbólowy); 3) etylomorfina (dionina o sile równej morfinie). 2. Pochodne fenylopiperydyny: 1) promedol (3-4 razy słabszy od morfiny); 2) fentanyl (100-400 razy silniejszy niż morfina). 3. Pochodne difenylometanu: 1) pirytramid (dipidolor) - równy morfinie; 2) tramadol (tramal) - nieco gorszy od morfiny. 4. Agoniści-antagoniści: 1) agoniści receptora opiatowego i antagoniści receptora opiatowego - buprenorfina (norfina) (25-30 razy silniejsza niż morfina); 2) agoniści receptora opiatowego i antagoniści receptora opiatowego - pentazocyna (lexir) (2-3 razy słabsza od morfiny) i butorfanol (moradol) (równy morfina). Agoniści-antagoniści znacznie rzadziej i słabiej niż pełnoprawni agoniści powodują euforię i uzależnienie od narkotyków. Narorfina - sama (np. przy zatruciu barbituranami) oraz przy łagodnym zatruciu morfiną działa przeciwbólowo, powoduje zwężenie źrenic, bradykardię, zaostrza depresję ośrodka oddechowego. W ciężkim zatruciu morfiną i innymi agonistami wypiera je z receptorów opiatowych ośrodka oddechowego i przywraca oddychanie. Powoduje dysforię, drażliwość, depresję, zaburzenia skupienia wzroku. Kompletni antagoniści receptora opioidowego Nalokson nie ma samodzielnego działania, jest skuteczny jako antidotum na zatrucia narkotycznymi lekami przeciwbólowymi. Narkotyczne środki przeciwbólowe powinny być stosowane tylko w ostrym bólu przez krótki czas. Najczęściej stosowany przy urazach, oparzeniach, zawale mięśnia sercowego, zapaleniu otrzewnej (po wyjaśnieniu diagnozy i podjęciu decyzji o operacji). Narkotyczne środki przeciwbólowe są częścią mieszanin litycznych do wzmocnienia znieczulenia. Leki z tej grupy stosuje się w bólu pooperacyjnym w połączeniu z M-antycholinergicznymi i miottropowymi środkami przeciwskurczowymi. Są przepisywane w celu zatrzymania kolki wątrobowej (pentazocyna) i nerkowej (promedol). Ból przewlekły jest przeciwwskazaniem do przepisywania leków, z wyjątkiem zaawansowanych postaci nowotworów złośliwych (dipidolor, tramadol, agonista-antagoniści). Narkotyczne środki przeciwbólowe łączy się z lekami psychotropowymi do specjalnych rodzajów znieczulenia. Neuroleptanalgezja to łagodzenie bólu dzięki połączeniu fentanylu (silny, trwa 30-40 minut) i droperydolu (łagodny lek przeciwpsychotyczny). Droperydol działa łagodnie uspokajająco, hamuje reakcje emocjonalne i zmniejsza napięcie mięśni szkieletowych. Również ważne działanie droperydolu ma działanie przeciwwymiotne i przeciwwstrząsowe. Dawki droperydolu - 1: 50. Połączony lek - talamonal. Neuroleptanalgezja stosowana jest w operacjach mało urazowych, w dziedzinie neurochirurgii oraz w kardiologii przy zawale mięśnia sercowego itp. Atalgezja lub analgezja uspokajająca - fentanyl w połączeniu z silnym środkiem uspokajającym, takim jak sibazon, fenazepam. Główną wadą jest silna depresja oddechowa fentanylu i zachowanie świadomości. Wykład nr 12. Znieczulenie. Rodzaje i etapy znieczulenia Znieczulenie ogólne lub znieczulenie to stan organizmu, który charakteryzuje się chwilowym wyłączeniem świadomości osoby, jej wrażliwości na ból i odruchów, a także rozluźnieniem mięśni mięśni szkieletowych, spowodowanym działaniem narkotycznych środków przeciwbólowych na centralny układ nerwowy. W zależności od sposobów wprowadzania leków do organizmu rozróżnia się znieczulenie wziewne i bezinhalacyjne. 1. Teorie znieczulenia Obecnie brak jest teorii znieczulenia, które jednoznacznie określałyby narkotyczny mechanizm działania środków znieczulających. Wśród dostępnych teorii znieczulenia najważniejsze są następujące. Leki mogą powodować określone zmiany we wszystkich narządach i układach. W okresie nasycenia organizmu narkotycznym środkiem przeciwbólowym następuje pewna inscenizacja zmiany świadomości, oddychania i krążenia krwi pacjenta. Dlatego istnieją etapy charakteryzujące głębokość znieczulenia. Te etapy ujawniają się szczególnie wyraźnie podczas znieczulenia eterem. Istnieją 4 etapy: 1) analgezja; 2) podniecenie; 3) etap chirurgiczny, podzielony na 4 poziomy; 4) etap przebudzenia. Etap analgezji Pacjent jest przytomny, ale obserwuje się pewien letarg, drzemie, odpowiada na pytania monosylabami. Wrażliwość powierzchowna i bólowa jest nieobecna, ale wrażliwość dotykowa i termiczna są zachowane. Na tym etapie wykonywane są krótkotrwałe interwencje chirurgiczne, takie jak otwieranie ropowicy, ropnie, badania diagnostyczne itp. Etap jest krótkotrwały, trwający 3-4 minuty. Faza wzbudzenia Na tym etapie ośrodki kory mózgowej są zahamowane, a ośrodki podkorowe znajdują się w tym czasie w stanie pobudzenia. Jednocześnie świadomość pacjenta jest całkowicie nieobecna, odnotowuje się wyraźne pobudzenie motoryczne i mowy. Pacjenci zaczynają krzyczeć, próbować wstawać ze stołu operacyjnego. Obserwuje się przekrwienie skóry, puls staje się częsty, wzrasta skurczowe ciśnienie krwi. Źrenica oka rozszerza się, ale reakcja na światło utrzymuje się, obserwuje się łzawienie. Często pojawia się kaszel, zwiększone wydzielanie oskrzeli, czasem wymioty. Nie można wykonać interwencji chirurgicznej na tle wzbudzenia. W tym okresie powinieneś nadal nasycać ciało narkotykiem w celu wzmocnienia znieczulenia. Czas trwania etapu zależy od ogólnego stanu pacjenta i doświadczenia anestezjologa. Zazwyczaj czas trwania wzbudzenia wynosi 7-15 minut. Etap chirurgiczny Wraz z początkiem tego etapu znieczulenia pacjent uspokaja się, oddech staje się spokojny i równomierny, częstość akcji serca i ciśnienie krwi zbliżają się do normy. W tym okresie możliwe są interwencje chirurgiczne. W zależności od głębokości znieczulenia rozróżnia się 4 stopnie i III stopień znieczulenia. Poziom pierwszy: pacjent jest spokojny, liczba ruchów oddechowych, liczba skurczów serca i ciśnienie krwi zbliżają się do wartości początkowych. Źrenica stopniowo zaczyna się zwężać, zachowuje się jego reakcja na światło. Jest płynny ruch gałek ocznych, ekscentryczny układ. Zachowały się odruchy rogówkowe i gardłowo-krtaniowe. Ton mięśni jest zachowany, dlatego operacje brzucha na tym poziomie nie są wykonywane. Drugi poziom: ruch gałek ocznych jest zatrzymany, są one unieruchomione w pozycji centralnej. Źrenice rozszerzają się, a ich reakcja na światło słabnie. Aktywność odruchów rogówkowych i gardłowo-krtaniowych zaczyna słabnąć ze stopniowym zanikiem pod koniec drugiego poziomu. Ruchy oddechowe są spokojne i równomierne. Wartości ciśnienia tętniczego i tętna przybierają normalne wartości. Zmniejsza się napięcie mięśni, co pozwala na operacje brzucha. Znieczulenie z reguły przeprowadza się w okresie pierwszego i drugiego poziomu. Trzeci poziom charakteryzuje się głębokim znieczuleniem. Jednocześnie źrenice oczu rozszerzają się w reakcji na silny bodziec świetlny. Jeśli chodzi o odruch rogówkowy, nie ma go. Następuje całkowite rozluźnienie mięśni szkieletowych, w tym mięśni międzyżebrowych. Z powodu tego ostatniego ruchy oddechowe stają się powierzchowne lub przeponowe. Dolna szczęka zwisa, gdy mięśnie się rozluźniają, korzeń języka opada i zamyka wejście do krtani. Wszystko to prowadzi do zatrzymania oddechu. Aby zapobiec tej komplikacji, dolna szczęka jest wysunięta do przodu i utrzymywana w tej pozycji. Na tym poziomie rozwija się tachykardia, a puls staje się małym wypełnieniem i napięciem. Spada poziom ciśnienia tętniczego. Przeprowadzenie znieczulenia na tym poziomie jest niebezpieczne dla życia pacjenta. czwarty poziom; maksymalna ekspansja źrenicy przy braku jej reakcji na światło, rogówka jest matowa i sucha. Biorąc pod uwagę, że rozwija się paraliż mięśni międzyżebrowych, oddychanie staje się powierzchowne i odbywa się poprzez ruchy przepony. Tachykardia jest charakterystyczna, podczas gdy puls staje się nitkowaty, częsty i trudny do określenia na obwodzie, ciśnienie krwi jest znacznie obniżone lub w ogóle nie jest wykrywane. Znieczulenie na czwartym poziomie zagraża życiu pacjenta, ponieważ może dojść do zatrzymania oddechu i krążenia. Etap przebudzenia Gdy tylko ustaje wprowadzanie środków odurzających, ich stężenie we krwi spada, a pacjent przechodzi przez wszystkie etapy znieczulenia w odwrotnej kolejności, następuje przebudzenie. 2. Przygotowanie pacjenta do znieczulenia Anestezjolog odgrywa bezpośrednią i często główną rolę w przygotowaniu pacjenta do znieczulenia i operacji. Obowiązkowym momentem jest badanie pacjenta przed operacją, ale jednocześnie ważna jest nie tylko choroba podstawowa, dla której ma być wykonana operacja, ale także obecność chorób współistniejących, o które szczegółowo pyta anestezjolog . Konieczne jest poznanie sposobu leczenia pacjenta z powodu tych chorób, efektu leczenia, czasu trwania leczenia, obecności reakcji alergicznych, czasu ostatniego zaostrzenia. Jeżeli pacjent podda się zabiegowi chirurgicznemu w zaplanowany sposób, wówczas w razie potrzeby przeprowadzana jest korekta istniejących chorób współistniejących. W przypadku rozchwianych i próchnicowych zębów istotne znaczenie ma higiena jamy ustnej, które mogą być dodatkowym i niepożądanym źródłem infekcji. Anestezjolog dowiaduje się i ocenia stan psychoneurologiczny pacjenta. Na przykład w schizofrenii stosowanie leków halucynogennych (ketaminy) jest przeciwwskazane. Operacja w okresie psychozy jest przeciwwskazana. W przypadku deficytu neurologicznego jest on wstępnie korygowany. Historia alergii ma ogromne znaczenie dla anestezjologa, ponieważ określa się nietolerancję na leki, a także na żywność, chemię gospodarczą itp. Jeśli pacjent ma zaostrzoną anamnezję alergiczną, nawet na leki, podczas znieczulenia reakcja alergiczna może rozwinąć się do wstrząsu anafilaktycznego. Dlatego środki odczulające (difenhydramina, suprastyna) są wprowadzane do premedykacji w dużych ilościach. Ważnym punktem jest obecność pacjenta w przebytych operacjach i znieczuleniu. Okazuje się, na czym polegało znieczulenie i czy były jakieś komplikacje. Zwraca się uwagę na stan somatyczny pacjenta: kształt twarzy, kształt i rodzaj klatki piersiowej, budowę i długość szyi, nasilenie tkanki tłuszczowej podskórnej, obecność obrzęków. Wszystko to jest niezbędne, aby dobrać odpowiednią metodę znieczulenia i leków. Pierwszą zasadą przygotowania pacjenta do znieczulenia podczas każdej operacji i przy stosowaniu jakiegokolwiek znieczulenia jest oczyszczenie przewodu pokarmowego (żołądek jest przepłukiwany przez rurkę, wykonuje się lewatywy oczyszczające). Aby stłumić reakcję psycho-emocjonalną i stłumić aktywność nerwu błędnego, przed operacją pacjentowi podaje się leki - premedykację. W nocy fenazepam jest przepisywany domięśniowo. Pacjentom z niestabilnym układem nerwowym przepisuje się środki uspokajające (seduxen, relanium) na dzień przed operacją. 40 minut przed zabiegiem podaje się domięśniowo lub podskórnie narkotyczne leki przeciwbólowe: 1 ml 1-2% roztworu promololu lub 1 ml pentozociny (leksyru), 2 ml fentanylu lub 1 ml 1% morfiny. W celu stłumienia funkcji nerwu błędnego i zmniejszenia wydzielania śliny podaje się 0,5 ml 0,1% roztworu atropiny. Bezpośrednio przed operacją jama ustna jest badana pod kątem obecności usuwalnych zębów i usuniętych protez. 3. Znieczulenie dożylne Zaletą dożylnego znieczulenia ogólnego jest szybkie wprowadzenie pacjenta do znieczulenia. Przy tego rodzaju znieczuleniu nie ma podniecenia, a pacjent szybko zasypia. Ale środki odurzające, które są stosowane do podawania dożylnego, powodują krótkotrwałe znieczulenie, więc nie mogą być stosowane w czystej postaci jako mononarkoza do długotrwałych operacji. Barbiturany – tiopental sodu i heksenal – są w stanie szybko wywołać sen narkotyczny, podczas gdy nie ma etapu pobudzenia, a wybudzenie jest szybkie. Obrazy kliniczne znieczulenia przeprowadzonego za pomocą tiopentalu sodu i heksenalu są podobne. Geksenal ma mniej hamujący wpływ na ośrodek oddechowy. Stosowane są świeżo przygotowane roztwory pochodnych kwasu barbiturowego. Zawartość fiolki (1 g leku) rozpuszcza się przed rozpoczęciem znieczulenia w 100 ml izotonicznego roztworu chlorku sodu (roztwór 1%). Nakłuwa się żyłę obwodową lub centralną (zgodnie ze wskazaniami) i przygotowany roztwór wstrzykuje się powoli z szybkością 1 ml przez 10-15 s. Po wstrzyknięciu roztworu w objętości 3-5 ml wrażliwość pacjenta na pochodne kwasu barbiturowego określa się w ciągu 30 sekund. Jeśli nie zauważy się reakcji alergicznej, kontynuuj wprowadzanie leku do chirurgicznego etapu znieczulenia. Od początku snu narkotycznego, przy pojedynczym wstrzyknięciu środka znieczulającego, czas trwania znieczulenia wynosi 10-15 minut. W celu podtrzymania znieczulenia barbiturany podaje się we frakcjach po 100-200 mg leku, do łącznej dawki nie większej niż 1 g. Podczas podawania barbituranów pielęgniarka prowadzi ewidencję tętna, ciśnienia krwi i oddychania. Anestezjolog monitoruje stan źrenicy, ruch gałek ocznych, obecność odruchu rogówkowego w celu określenia poziomu znieczulenia. Znieczulenie barbituranami, zwłaszcza tiopentalem sodowym, charakteryzuje się depresją ośrodka oddechowego, dlatego konieczna jest obecność sztucznego aparatu oddechowego. W przypadku zatrzymania oddechu (bezdechu) wykonuje się sztuczną wentylację płuc (ALV) za pomocą maski aparatu oddechowego. Szybkie podanie tiopentalu sodu może prowadzić do obniżenia ciśnienia krwi i depresji serca. W takim przypadku podawanie leku zostaje zatrzymane. W chirurgii znieczulenie barbituranami jako mononarkozą stosuje się do krótkotrwałych operacji, które nie trwają dłużej niż 20 minut (np. otwarcie ropni, ropowica, redukcja zwichnięć, manipulacje diagnostyczne, repozycjonowanie fragmentów kości). Pochodne kwasu barbiturowego stosuje się również do znieczulenia indukcyjnego. Viadryl (predion do wstrzykiwań) stosuje się w dawce 15 mg/kg, przy łącznej dawce średnio 1000 mg. Viadryl stosuje się głównie w małych dawkach wraz z podtlenkiem azotu. W dużych dawkach lek ten może powodować obniżenie ciśnienia krwi. Powikłaniem jego stosowania jest rozwój zapalenia żył i zakrzepowego zapalenia żył. Aby zapobiec ich rozwojowi, zaleca się powolne podawanie leku do żyły centralnej w postaci 2,5% roztworu. Viadryl służy do badań endoskopowych jako wstępny rodzaj znieczulenia. Propanidid (epontol, sombrevin) jest dostępny w ampułkach po 10 ml 5% roztworu. Dawka leku wynosi 7-10 mg / kg, podawana dożylnie, szybko (cała dawka to 500 mg w 30 sekund). Sen przychodzi natychmiast - „na końcu igły”. Czas trwania snu anestezjologicznego wynosi 5-6 minut. Przebudzenie jest szybkie, spokojne. Stosowanie propanidydu powoduje hiperwentylację, która pojawia się natychmiast po utracie przytomności. Czasami może wystąpić bezdech. W takim przypadku wentylację należy prowadzić za pomocą aparatu oddechowego. Negatywną stroną jest możliwość powstania niedotlenienia na tle podawania leku. Konieczna jest kontrola ciśnienia krwi i pulsu. Lek stosuje się do znieczulenia indukcyjnego w ambulatoryjnej praktyce chirurgicznej do małych operacji. Hydroksymaślan sodu podaje się dożylnie bardzo powoli. Średnia dawka wynosi 100-150 mg/kg. Lek powoduje powierzchowne znieczulenie, dlatego często stosuje się go w połączeniu z innymi środkami odurzającymi, takimi jak barbiturany – propanidyd. Jest często używany do znieczulenia indukcyjnego. Ketamina (ketalar) może być stosowana do podawania dożylnego i domięśniowego. Szacowana dawka leku to 2-5 mg/kg. Ketaminę można stosować w mononarkozie oraz w znieczuleniu indukcyjnym. Lek powoduje powierzchowny sen, stymuluje aktywność układu sercowo-naczyniowego (wzrost ciśnienia krwi, przyspieszenie tętna). Wprowadzenie leku jest przeciwwskazane u pacjentów z nadciśnieniem. Szeroko stosowany we wstrząsie u pacjentów z niedociśnieniem. Skutkami ubocznymi ketaminy mogą być nieprzyjemne halucynacje pod koniec znieczulenia i po przebudzeniu. 4. Znieczulenie wziewne Znieczulenie wziewne przeprowadza się za pomocą łatwo odparowujących (lotnych) cieczy - eteru, halotanu, metoksyfluranu (pentranu), trichloroetylenu, chloroformu lub gazowych substancji odurzających - podtlenku azotu, cyklopropanu. W znieczuleniu dotchawiczym substancja narkotyczna dostaje się do organizmu z aparatu do znieczulenia przez rurkę wprowadzoną do tchawicy. Zaletą metody jest to, że zapewnia drożność dróg oddechowych i może być stosowana w operacjach szyi, twarzy, głowy, eliminuje możliwość aspiracji wymiocin, krwi; zmniejsza ilość stosowanego leku; poprawia wymianę gazową poprzez zmniejszenie „martwej” przestrzeni. Znieczulenie dotchawicze jest wskazane przy dużych zabiegach chirurgicznych, jest stosowane jako znieczulenie wieloskładnikowe ze środkami zwiotczającymi mięśnie (znieczulenie złożone). Całkowite stosowanie kilku leków w małych dawkach zmniejsza toksyczny wpływ na organizm każdego z nich. Nowoczesne znieczulenie mieszane służy do znieczulenia, wyłączenia świadomości, odprężenia. Znieczulenie i wyłączenie przytomności odbywa się za pomocą jednej lub więcej substancji odurzających – wziewnych lub niewdychanych. Znieczulenie przeprowadza się na pierwszym poziomie etapu chirurgicznego. Rozluźnienie lub rozluźnienie mięśni uzyskuje się przez frakcyjne podawanie środków zwiotczających mięśnie. 5. Etapy znieczulenia Istnieją trzy etapy znieczulenia. 1. Wprowadzenie do znieczulenia. Znieczulenie wstępne można przeprowadzić dowolną substancją narkotyczną, przeciwko której występuje dość głęboki sen znieczulający bez etapu wzbudzenia. Najczęściej stosuje się barbiturany, fentanyl w połączeniu z sombrevinem, zmielone z sombrevinem. Często stosuje się również tiopental sodu. Leki stosuje się w postaci 1% roztworu, podaje się je dożylnie w dawce 400-500 mg. Na tle znieczulenia indukcyjnego podaje się środki zwiotczające mięśnie i wykonuje się intubację tchawicy. 2. Utrzymanie znieczulenia. W celu utrzymania znieczulenia ogólnego można zastosować dowolny narkotyk, który może chronić organizm przed urazami chirurgicznymi (halotan, cyklopropan, podtlenek azotu z tlenem), a także neuroleptanalgezję. Znieczulenie utrzymuje się na pierwszym i drugim poziomie etapu operacyjnego, a w celu zniesienia napięcia mięśniowego podaje się środki zwiotczające mięśnie, które powodują mioplegię wszystkich grup mięśni szkieletowych, w tym oddechowych. Dlatego głównym warunkiem nowoczesnej połączonej metody znieczulenia jest wentylacja mechaniczna, którą przeprowadza się poprzez rytmiczne ściskanie torby lub futra lub za pomocą aparatu do sztucznego oddychania. Ostatnio najbardziej rozpowszechniona neuroleptanalgezja. Dzięki tej metodzie do znieczulenia stosuje się podtlenek azotu z tlenem, fentanyl, droperydol, środki zwiotczające mięśnie. Znieczulenie wstępne dożylne. Znieczulenie utrzymuje się przez inhalację podtlenku azotu tlenem w stosunku 2:1, frakcyjne dożylne podawanie fentanylu i droperydolu 1-2 ml co 15-20 minut. Przy zwiększonej częstości akcji serca podaje się fentanyl, ze wzrostem ciśnienia krwi - droperydol. Ten rodzaj znieczulenia jest bezpieczniejszy dla pacjenta. Fentanyl zwiększa ulgę w bólu, droperydol hamuje reakcje wegetatywne. 3. Wycofanie się ze znieczulenia. Pod koniec operacji anestezjolog stopniowo wstrzymuje podawanie substancji odurzających i zwiotczających mięśnie. Świadomość powraca do pacjenta, przywracany jest niezależny oddech i napięcie mięśniowe. Kryterium oceny adekwatności oddychania spontanicznego są wskaźniki RO2, RSO2, pH. Po przebudzeniu, przywróceniu spontanicznego oddychania i napięcia mięśni szkieletowych anestezjolog może ekstubować pacjenta i przetransportować go na dalszą obserwację na sali pooperacyjnej. 6. Metody monitorowania przebiegu znieczulenia Podczas znieczulenia ogólnego stale określane i oceniane są główne parametry hemodynamiki. Mierz ciśnienie krwi, tętno co 10-15 minut. U osób z chorobami układu sercowo-naczyniowego, a także przy operacjach klatki piersiowej konieczne jest stałe monitorowanie funkcji mięśnia sercowego. Obserwację elektroencefalograficzną można wykorzystać do określenia poziomu znieczulenia. Aby kontrolować wentylację płuc i zmiany metaboliczne podczas znieczulenia i operacji konieczne jest przeprowadzenie badania stanu kwasowo-zasadowego (RO2, RSO2, pH, BE). Podczas znieczulenia pielęgniarka prowadzi kartę znieczulenia pacjenta, w której koniecznie zapisuje główne wskaźniki homeostazy: częstość tętna, ciśnienie krwi, ośrodkowe ciśnienie żylne, częstość oddechów i parametry respiratora. Na tej mapie wszystkie etapy znieczulenia i zabiegu chirurgicznego są ustalone, wskazane są dawki substancji odurzających i środków zwiotczających mięśnie. Odnotowuje się wszystkie leki stosowane podczas znieczulenia, w tym media do transfuzji. Rejestrowany jest czas wszystkich etapów operacji i podawania leków. Pod koniec operacji wskazana jest całkowita liczba wszystkich użytych środków, co znajduje również odzwierciedlenie w karcie znieczulenia. Zapisuje się wszystkie powikłania podczas znieczulenia i operacji. Karta znieczulenia jest osadzona w historii choroby. 7. Powikłania znieczulenia Powikłania podczas znieczulenia mogą wystąpić z powodu niewłaściwej techniki znieczulenia lub wpływu środków znieczulających na narządy życiowe. Jedną z takich komplikacji są wymioty. Na początku wprowadzania znieczulenia wymioty mogą być związane z charakterem choroby dominującej (zwężenie odźwiernika, niedrożność jelit) lub z bezpośrednim działaniem leku na ośrodek wymiotny. Na tle wymiotów aspiracja jest niebezpieczna - przedostawanie się treści żołądkowej do tchawicy i oskrzeli. Treść żołądka, która ma wyraźną kwaśną reakcję, opadając na struny głosowe, a następnie wnikając do tchawicy, może prowadzić do skurczu krtani lub skurczu oskrzeli, powodując niewydolność oddechową z późniejszym niedotlenieniem - jest to tak zwany zespół Mendelssohna, któremu towarzyszy sinica, skurcz oskrzeli, częstoskurcz. Niebezpieczna może być regurgitacja - bierne wrzucanie treści żołądkowej do tchawicy i oskrzeli. Zwykle dzieje się to na tle głębokiego znieczulenia za pomocą maski z rozluźnieniem zwieraczy i przelewem żołądka lub po wprowadzeniu środków zwiotczających mięśnie (przed intubacją). Połknięcie do płuc podczas wymiotów lub zwracania kwaśnej treści żołądkowej prowadzi do ciężkiego zapalenia płuc, często śmiertelnego. Aby uniknąć pojawienia się wymiotów i regurgitacji, przed znieczuleniem należy usunąć jego zawartość z żołądka sondą. U pacjentów z zapaleniem otrzewnej i niedrożnością jelit sonda pozostaje w żołądku przez cały czas znieczulenia, przy czym konieczna jest umiarkowana pozycja Trendelenburga. Przed rozpoczęciem znieczulenia, aby zapobiec regurgitacji, można zastosować metodę Selicka - ucisk na chrząstkę pierścieniowatą z tyłu, co powoduje zaciskanie przełyku. W przypadku wystąpienia wymiotów konieczne jest szybkie usunięcie treści żołądkowej z jamy ustnej wymazem i odsysaniem, w przypadku regurgitacji treść żołądkową odsysa się przez cewnik wprowadzony do tchawicy i oskrzeli. Wymioty, a następnie aspiracja mogą wystąpić nie tylko podczas znieczulenia, ale także po przebudzeniu pacjenta. Aby zapobiec aspiracji w takich przypadkach, konieczne jest, aby pacjent przyjął pozycję poziomą lub pozycję Trendelenburga, odwracając głowę na bok. Pacjent powinien być monitorowany. Powikłania ze strony układu oddechowego mogą wystąpić z powodu upośledzenia drożności dróg oddechowych. Może to być spowodowane wadami aparatu do znieczulenia. Przed rozpoczęciem znieczulenia należy sprawdzić działanie urządzenia, jego szczelność oraz przepuszczalność gazów przez węże oddechowe. Niedrożność dróg oddechowych może wystąpić w wyniku cofnięcia języka podczas głębokiego znieczulenia (III stopień chirurgicznego etapu znieczulenia). Podczas znieczulenia do górnych dróg oddechowych mogą dostać się ciała obce lite (zęby, protezy). Aby zapobiec tym powikłaniom, konieczne jest wysunięcie i podparcie żuchwy na tle głębokiego znieczulenia. Przed znieczuleniem należy usunąć protezy, zbadać zęby pacjenta. Powikłania intubacji tchawicy wykonywanej metodą laryngoskopii bezpośredniej można podzielić na: 1) uszkodzenie zębów przez ostrze laryngoskopu; 2) uszkodzenie strun głosowych; 3) wprowadzenie rurki dotchawiczej do przełyku; 4) wprowadzenie rurki dotchawiczej do oskrzela prawego; 5) wyjście rurki dotchawiczej z tchawicy lub jej zgięcie. Opisanym powikłaniom można zapobiec dzięki dokładnej znajomości techniki intubacji i kontroli położenia rurki dotchawiczej w tchawicy powyżej jej rozwidlenia (za pomocą osłuchiwania płuc). Powikłania z układu krążenia. Spadek ciśnienia krwi zarówno w okresie znieczulenia, jak i podczas znieczulenia może wystąpić z powodu wpływu substancji narkotycznych na czynność serca lub na ośrodek naczyniowo-ruchowy. Dzieje się tak przy przedawkowaniu substancji odurzających (często halotanu). Niedociśnienie może wystąpić u pacjentów z niskim BCC przy optymalnej dawce substancji odurzających. Aby zapobiec temu powikłaniu, konieczne jest uzupełnienie deficytu BCC przed znieczuleniem, a podczas operacji, której towarzyszy utrata krwi, przetoczenie roztworów zastępujących krew i krew. Zaburzenia rytmu serca (częstoskurcz komorowy, dodatkowy skurcz, migotanie komór) mogą wystąpić z wielu powodów: 1) niedotlenienie i hiperkapnia wynikające z przedłużonej intubacji lub niedostatecznej wentylacji podczas znieczulenia; 2) przedawkowanie substancji odurzających – barbituranów, halotanu; 3) stosowanie epinefryny na tle halotanu, co zwiększa wrażliwość halotanu na katecholaminy. Do określenia rytmu serca potrzebna jest kontrola elektrokardiograficzna. Leczenie odbywa się w zależności od przyczyny powikłania i obejmuje eliminację niedotlenienia, zmniejszenie dawki leku, stosowanie leków chininowych. Zatrzymanie akcji serca jest najgroźniejszym powikłaniem podczas znieczulenia. Powodem tego jest najczęściej nieprawidłowa kontrola stanu pacjenta, błędy w technice znieczulenia, niedotlenienie, hiperkapnia. Leczenie polega na natychmiastowej resuscytacji krążeniowo-oddechowej. Powikłania z układu nerwowego. Podczas znieczulenia ogólnego dopuszcza się umiarkowany spadek temperatury ciała w wyniku oddziaływania substancji odurzających na centralne mechanizmy termoregulacji i chłodzenia pacjenta na sali operacyjnej. Ciało pacjentów z hipotermią po znieczuleniu próbuje przywrócić temperaturę ciała z powodu zwiększonego metabolizmu. Na tym tle pod koniec znieczulenia i po nim pojawiają się dreszcze, co obserwuje się po znieczuleniu halotanem. Aby zapobiec hipotermii, należy monitorować temperaturę na sali operacyjnej (21-22 ° C), w razie potrzeby przykryć pacjenta terapią infuzyjną, wlać roztwory ogrzane do temperatury ciała i wdychać ciepłe, zwilżone środki odurzające. Obrzęk mózgu jest konsekwencją długotrwałego i głębokiego niedotlenienia podczas znieczulenia. Leczenie powinno być natychmiastowe, konieczne jest przestrzeganie zasad odwodnienia, hiperwentylacji, miejscowego chłodzenia mózgu. Uszkodzenie nerwów obwodowych. To powikłanie występuje dzień lub dłużej po znieczuleniu. Najczęściej uszkodzeniu ulegają nerwy kończyn górnych i dolnych oraz splot ramienny. Wynika to z nieprawidłowej pozycji pacjenta na stole operacyjnym (odwodzenie ręki o więcej niż 90° od ciała, umieszczenie ręki za głową, zamocowanie ręki do łuku stołu operacyjnego, ułożenie nóg na uchwyty bez wyściółki). Prawidłowa pozycja pacjenta na stole eliminuje napięcie pni nerwowych. Leczenie prowadzone jest przez neuropatologa i fizjoterapeutę. Wykład nr 13. Znieczulenie miejscowe 1. Znieczulenie powierzchniowe Ten rodzaj znieczulenia przeprowadza się przez kontakt substancji znieczulającej z jednym lub drugim narządem, jego powierzchnią. W tym celu 1-3% roztwór kokainy, 0,25-2% roztwór dikainy, 1-2% roztwór lidokainy, 1-5% roztwór trimekainy i 0,5-2% roztwór piromekainy. Większość środków znieczulających miejscowo wiąże się z unieczynnionymi kanałami sodowymi, zapobiegając ich aktywacji i przedostawaniu się sodu do komórki podczas depolaryzacji błony, uzyskując w ten sposób efekt przeciwbólowy. Technika znieczulenia powierzchniowego jest prosta i polega na nasmarowaniu, zakropleniu roztworu lub rozpyleniu go za pomocą specjalnych pistoletów natryskowych. Początek działania środka znieczulającego jest zależny od pH, przy czym niskie pH zabiera więcej czasu niż przy wysokim pH. Czas działania środka znieczulającego zależy od stopnia jego związania z białkami. Ten rodzaj znieczulenia znajduje zastosowanie w manipulacjach diagnostycznych oraz w okulistyce, otorynolaryngologii. 2. Znieczulenie regionalne Znieczulenie regionalne obejmuje znieczulenie splotowe, przewodzące, zewnątrzoponowe, przykręgowe i inne. W przeciwieństwie do znieczulenia ogólnego, znieczulenie regionalne zapewnia odpowiednią analgezję chirurgiczną dzięki obwodowej blokadzie impulsów bólowych przy zachowaniu prawidłowych funkcji życiowych. Znieczulenie miejscowe jest trudne technicznie i wymaga dokładnej znajomości anatomicznej i topograficznej lokalizacji splotu nerwowego lub przewodnika nerwowego, wyraźnej orientacji w stałych punktach identyfikacyjnych (występy kostne, tętnice, mięśnie), umiejętności oceny oporności tkanek i odczuć pacjenta. Aby wyłączyć wrażliwość na ból, wystarczy wprowadzić 1% roztwór trimekainy (lidokainy), a aby wyłączyć wrażliwość proprioceptywną i osiągnąć rozluźnienie mięśni, należy użyć bardziej skoncentrowanych roztworów znieczulających miejscowo (na przykład trimekainy 2-2,5% ). Przywrócenie wrażliwości przebiega w odwrotnej kolejności, tj. najpierw pojawiają się odczucia napięcia mięśniowego i proprioceptywnego, a następnie odczucia bólu i temperatury. Należy wziąć pod uwagę, że wraz ze wzrostem stężenia i ilości środka miejscowo znieczulającego wzrasta jego toksyczność. Najczęściej stosowanymi roztworami są trimekaina 1-2%, lidokaina 1-2% i bupiwokaina 0,75-0,5%. Miejscowe środki znieczulające łatwiej i szybciej blokują pozbawione mieliny i cienkie włókna mielinowe (wszystkie wegetatywne, a także przewodzące temperaturę i bodźce bólowe). Grube włókna mielinowe przechodzące do mięśni szkieletowych, receptorów dotykowych i proprioceptorów są wysoce odporne na znieczulenie, ponieważ oddziałuje na nie znieczulenie miejscowe w obszarze przechwytów Ranviera. Dyfuzja środka znieczulającego do lipidowej części włókna nerwowego jest szybka, ale tylko do czasu, gdy stężenie poza nerwem jest wyższe niż w samym nerwie. Po zmianie tego stosunku środek znieczulający dyfunduje w przeciwnym kierunku od nerwu do otaczających tkanek. Słabo stężone roztwory znieczulające podawane w dużych ilościach rozprzestrzeniają się szeroko, ale ich dyfuzja jest znikoma. Skoncentrowane roztwory wprowadzane w małych ilościach mają dobry stopień dyfuzji. Efekt znieczulenia zależy od ilości środka znieczulającego wnikającego przezkroczowo i powodującego odpowiednią blokadę progową. Podwojenie stężenia wstrzykiwanego środka znieczulającego wydłuża znieczulenie o 1/3, a wprowadzenie podwójnej objętości – tylko o 3-9%. Miejscowe środki znieczulające często prowadzą do reakcji anafilaktycznych. Trimekaina: czas działania wynosi 1-1,5 godziny, maksymalna pojedyncza dawka to 800-1000 mg Lidokaina (ksykaina) jest stosowana w 1-2% roztworze, czas znieczulenia wynosi do 2,5-3 godzin Bupiwokaina (markaina) ) stosowany w roztworze 0,5-0,75% w maksymalnej jednorazowej dawce 150-170 mg, czas działania 8-12 h. W przypadku stosowania długodziałających anestetyków dodatek lidokainy wyraźnie przyspiesza początek działania, zmniejszając okres utajony. Podczas przeprowadzania znieczulenia regionalnego musisz znać i przestrzegać ogólnych zasad: 1) jasne poznanie cech anatomicznych i topograficznych splotów nerwowych i przewodników w obszarze proponowanego znieczulenia, a także techniki wykonania znieczulenia; 2) dobrać odpowiedni środek miejscowo znieczulający, określić jego stężenie, dawkę całkowitą i sposób podania do splotu nerwowego lub przewodnika; 3) ocenić stan pacjenta i ustalić podłoże alergiczne i farmakoterapeutyczne; 4) ostrzec pacjenta o możliwym zachowaniu głębokiej wrażliwości dotykowej i proprioceptywnej podczas znieczulenia przewodowego i splotowego; 5) stałe monitorowanie hemodynamiki i oddychania pacjenta po znieczuleniu; 6) przed lub bezpośrednio po znieczuleniu wykonać nakłucie żyły i podjąć działania zapobiegające ewentualnym powikłaniom; 7) przeprowadzać zgodnie ze środkami aseptycznymi i antyseptycznymi, a przed nakłuciem ostrożnie usuwać substancje chemicznie czynne (jod, chlorheksydyna itp.) z powierzchni skóry; 8) przed wprowadzeniem znieczulenia miejscowego konieczne jest wykonanie testu aspiracyjnego, aby zapobiec przedostaniu się igły do naczynia tętniczego; 9) pamiętać, że parestezje odczuwane przez pacjenta podczas znieczulenia regionalnego są warunkiem powodzenia uzyskania analgezji; jego brak wskazuje na możliwą awarię; 10) w celu ułatwienia odnalezienia przewodnika nerwowego lub splotu wskazane jest zastosowanie stymulacji elektrycznej poprzez podanie impulsu ujemnego na igłę, a impulsu dodatniego (anody) na biegun obojętny elektrody, który jest zamocowany na ciele pacjenta skóra. 3. Znieczulenie splotu szyjnego (ASP) OZW, wykonywane jedno lub dwustronnie, pozwala na wykonanie wszelkich operacji na szyi, tarczycy, naczyniach ramienno-głowowych w przypadku ran postrzałowych, urazów i chorób nowotworowych. Splot szyjny (Plexus cervicalis) powstaje z przednich gałęzi czterech górnych nerwów szyjnych (C1-C4) przy ich wyjściu z otworów międzykręgowych. Znajduje się na przedniej powierzchni środkowego mięśnia pochylnego i mięśnia unoszącego łopatkę, poprzecznie do wyrostków poprzecznych kręgów szyjnych. Nerwy ruchowe splotu szyjnego unerwiają mięśnie szyi, a nerwy czuciowe unerwiają skórę okolicy potylicznej głowy, przednią i boczną powierzchnię szyi, obszar podobojczykowy do poziomu żeber I i II oraz małżowina uszna. Największym nerwem splotu szyjnego jest przepon (p. prenicus), który powstaje z C3-C4 a rzadziej ze względu na dodatkową gałąź z C5. Większość nerwów czuciowych wychodzi pośrodku spod tylnej krawędzi mięśnia mostkowo-obojczykowo-sutkowego i rozchodzi się w powierzchownych warstwach szyi, skóry okolicy potylicznej głowy i górnej części klatki piersiowej. W przypadku znieczulenia wrażliwych nerwów splotu szyjnego wzdłuż tylnej krawędzi pośrodku mięśnia mostkowo-obojczykowo-sutkowego można wykonać szereg operacji na szyi, ale należy pamiętać, że znieczulenie musi być obustronne, ponieważ nerwy zespalają się wzdłuż linia środkowa szyi. W przypadku dużych operacji w głębokich warstwach szyi (strumektomia, usunięcie guzów szyi, laryngektomia, endarterektomia tętnicy szyjnej itp.) Konieczne jest znieczulenie splotu szyjnego z dostępu przedniego. Przy dostępie bocznym istnieje ryzyko poważnych powikłań (wprowadzenie do przestrzeni podtwardówkowej roztworu znieczulającego), dlatego nie jest on stosowany. Aby wykonać ASS z podejściem przednim, konieczne jest, aby pacjent położył się na plecach z małą rolką pod szyją. Głowa powinna leżeć płasko, prosto w linii pośrodkowej bez obracania lub być lekko odwrócona w kierunku przeciwnym do nakłucia. Ręce wzdłuż ciała, anestezjolog stoi na czele nakłucia. Punkty orientacyjne: mięsień mostkowo-obojczykowo-sutkowy, kość gnykowa, tętnica szyjna wewnętrzna i kąt żuchwy. Technika znieczulenia 2 cm poniżej kąta żuchwy, przed mięśniem mostkowo-obojczykowo-sutkowym, określa się pulsację tętnicy szyjnej wewnętrznej. Pozioma gałąź kości gnykowej odpowiada poziomowi wyrostka poprzecznego kręgu C3. Punkt wstrzyknięcia igły znajduje się na przecięciu linii, która jest kontynuacją poziomej gałęzi kości gnykowej, z przednią krawędzią mięśnia mostkowo-obojczykowo-sutkowego. W tym miejscu przecięcia, w warunkach aseptycznych, tworzy się „skórka cytryny”, przez którą wprowadzana jest igła iniekcyjna z zewnątrz do wewnątrz i od przodu do tyłu, posuwając ją przyśrodkowo do mięśnia mostkowo-obojczykowo-sutkowego i za tętnicę szyjną wewnętrzną. tętnicy (w szczelinie między mięśniem mostkowo-obojczykowo-sutkowym a wyczuwalną tętnicą szyjną wewnętrzną) do momentu pojawienia się parestezji u pacjenta lub uderzenia igły w wyrostek poprzeczny kręgu C3. Głębokość wstrzyknięcia nie przekracza 2-5 cm Igła jest bezpiecznie zamocowana w tej pozycji i wykonywany jest test aspiracji, określający, czy koniec igły znajduje się w świetle naczynia. W celu znieczulenia z obu stron wstrzykuje się 10-12 ml 2% roztworu trimekainy. Aby wzmocnić znieczulenie splotu szyjnego, można dodatkowo zablokować powierzchowne gałęzie, które docierają do przedniej powierzchni szyi. Miejscem ich wyjścia jest środek tylnej krawędzi mięśnia mostkowo-obojczykowo-sutkowego. Igła jest wstrzykiwana w miejscu ich wyjścia pod powierzchowną powięź szyi. Roztwór 2% trimekainy podaje się w ilości 3-5 ml doczaszkowo i doogonowo (w kształcie wachlarza). Odpowiednie znieczulenie następuje po 8-12 minutach i zapewnia skuteczną ulgę w bólu u większości pacjentów w ciągu 1,5-2 godzin. Komplikacje Zespół Hornera, blokada nerwów przeponowych, nawracający niedowład nerwów, niedociśnienie z donaczyniowym wstrzyknięciem środka znieczulającego. Chrypka jest głównym objawem blokady splotu szyjnego. Najgroźniejszym powikłaniem z dostępem bocznym jest rozwój wysokiego znieczulenia podpajęczynówkowego i dostanie się środka znieczulającego do jamy komory IV, którego objawami są porażenie ośrodków opuszkowych, rozszerzenie źrenic, obniżenie ciśnienia krwi, niewydolność oddechowa i atonia mięśni . Bezwzględnymi przeciwwskazaniami do znieczulenia splotu szyjnego są niedowład nerwu przeponowego po przeciwnej stronie, uszkodzenie nerwów splotu szyjnego. 4. Znieczulenie splotu ramiennego (APS) APS umożliwia wykonywanie wszelkich operacji na kończynie górnej, stawie barkowym, barku, przedramieniu i dłoni: amputacje, chirurgiczne leczenie ran z repozycjonowaniem i utrwalaniem odłamów kostnych, operacje na naczyniach krwionośnych i nerwach, redukcja zwichnięć barku itp. Wysoka Częstość zabiegów chirurgicznych na kończynie górnej, zwłaszcza w czasie wojny, rodzi pytanie o racjonalne metody znieczulenia podczas tych operacji. Topograficznie istnieją 2 części splotu ramiennego: nadobojczykowa i podobojczykowa. Gałęzie rozciągają się od części nadobojczykowej do głębokich mięśni szyi i mięśni obręczy barkowej. Podobojczykowa część splotu ramiennego składa się z trzech pni obejmujących tętnicę pachową od strony wewnętrznej, tylnej i zewnętrznej. Długie nerwy wychodzą z pni do wolnej części kończyny górnej, a jeden krótki do obręczy barkowej. Z pnia wewnętrznego odchodzi nerw łokciowy i dolny korzeń do nerwu pośrodkowego; nerw promieniowy i pachowy odchodzą od tułowia tylnego, a nerw mięśniowo-skórny i górny korzeń nerwu pośrodkowego odchodzą od tułowia zewnętrznego. Dzięki temu znieczulenie splotu ramiennego możliwe jest na różne sposoby z dostępu nadobojczykowego, pachowego i podobojczykowego. Spośród podejść nadobojczykowych najszerzej stosowane są metody znieczulenia w przestrzeni śródmiąższowej jako najprostsze, niezawodne i mające mniej powikłań. Znieczulenie splotu ramiennego według Winnie Pacjent leży na plecach, głowa jest odwrócona w kierunku przeciwnym do miejsca nakłucia, podbródek jest przyłożony do przeciwległej obręczy barkowej. Ręka od strony nakłucia leży wzdłuż ciała, lekko ściągnięta w dół. Charakterystyczne obiekty: mięsień mostkowo-obojczykowo-sutkowy, łuska przednia, przestrzeń śródmiąższowa, żyła szyjna zewnętrzna, obojczyk, chrząstka pierścieniowata. Technika znieczulenia. Skórę traktuje się roztworem antyseptycznym. Za mięśniem mostkowo-obojczykowo-sutkowym, wyraźnie zarysowanym z lekkim uniesieniem głowy, na poziomie chrząstki pierścieniowatej, opuszki palców lewej ręki są umieszczone na mięśniu pochyłym przednim. Przy dalszym przesunięciu palców w bok o 0,5-1,5 cm między przednimi i środkowymi mięśniami pochyłymi bada się szczelinę międzypochylną. Staje się bardziej wyraźny przy głębokim oddechu, ponieważ napina mięśnie pochyłe. Na głębokości przestrzeni śródmiąższowej wyczuwane są poprzeczne procesy kręgów szyjnych (uczucie silnego oporu), a przy zwiększonym nacisku czubkiem palca często dochodzi do parestezji w barku lub obręczy barkowej; bardziej doogonowo, w przestrzeni śródmiąższowej, można wyczuć tętnicę podobojczykową. Przestrzeń śródmiąższową w górnej części przecina żyła szyjna zewnętrzna. Punkt wstrzyknięcia igły znajduje się w górnej części przestrzeni śródmiąższowej na poziomie chrząstki pierścieniowatej. W tym momencie powstaje „skorupka cytrynowa”, a przez nią igła jest skierowana do środka i nieco w dół, od przodu do tyłu (w kierunku grzbietowym) do wyrostka poprzecznego C6 pod kątem 30° do płaszczyzny strzałkowej. Gdy igła jest przesunięta do wewnątrz w odległości 1,5-4 cm, dochodzi do parestezji, a czubek igły spoczywa na wyrostku poprzecznym szóstego kręgu szyjnego. W tej pozycji igłę mocuje się lub podciąga o 6-1 mm, a po teście aspiracyjnym 2-30 ml 40% roztworu trimekainy (lidokainy) lub 2-0,5% roztworu bupiwokainy (markainy) wstrzyknięty. Podczas wprowadzania pierwszych mililitrów roztworu znieczulenia miejscowego pacjent odczuwa krótkotrwały ból („porażenie prądem”), wskazujący na prawidłowe położenie końcówki igły. W przypadku braku parestezji położenie końcówki igły można sprawdzić, wprowadzając 0,75 ml 0,5% roztworu chlorku sodu wyjętego z lodówki. Pojawienie się uczucia bólu w kończynie górnej wskazuje na kontakt zimnego roztworu z nerwem. Przeciwwskazania: niedowład nerwu wstecznego lub przeponowego po przeciwnej stronie, uszkodzenie nerwów splotu ramiennego. Możliwe powikłania: donaczyniowe wstrzyknięcie roztworu znieczulenia miejscowego, zwłaszcza do tętnicy kręgowej, której szybka dyfuzja prowadzi do zatrucia OUN; podpajęczynówkowe podanie roztworu znieczulającego powoduje całkowitą blokadę kręgosłupa; podanie zewnątrzoponowe skutkuje wysokim znieczuleniem zewnątrzoponowym. Znieczulenie splotu ramiennego w przestrzeni śródmiąższowej zgodnie z metodą S. V. Gavrilina i L. G. Tichonowa Główną różnicą tej metody od innych jest brak kopuły opłucnej i dużych naczyń krwionośnych w miejscu nakłucia. Pacjent leży na plecach, głowa jest odwrócona w kierunku przeciwnym do miejsca nakłucia, podbródek jest przyłożony do przeciwległej obręczy barkowej. Pod ramionami umieszcza się mały wałek, ramię od strony nakłucia leży wzdłuż ciała. Charakterystyczne obiekty: obojczyk, mięsień mostkowo-obojczykowo-sutkowy. Technika znieczulenia. Punkt wstrzyknięcia igły znajduje się w górnej części prostopadłej, przywróconej od górnej krawędzi środka obojczyka, którego długość wynosi ¼ długości mięśnia mostkowo-obojczykowo-sutkowego. W tym momencie tworzy się „skórka cytryny”, igłę do iniekcji domięśniowej wprowadza się pod kątem 60 ° do powierzchni skóry, natomiast igła i wyimaginowana lub narysowana prostopadłość powinny znajdować się w tej samej płaszczyźnie. Igłę wprowadza się w kierunku wyrostka poprzecznego VI kręgu szyjnego do momentu pojawienia się parestezji w kończynie górnej. W przypadku braku parestezji igłę wprowadza się do wyrostka poprzecznego 6 kręgu szyjnego i po przyciągnięciu do siebie o 6-1 mm wstrzykuje się 2-30 ml 40% roztworu trimekainy lub lidokainy . Głębokość wkłucia igły wynosi 2-2 cm. Znieczulenie splotu ramiennego w modyfikacji V. S. Sokołowskiego Pacjent leży na plecach, głowa znajduje się w linii środkowej, ramiona leżą wzdłuż ciała. Punkty orientacyjne: mięsień mostkowo-obojczykowo-sutkowy i obojczyk. Technika znieczulenia. Aby ułatwić odnalezienie punktu na skórze szyi, po stronie znieczulenia buduje się trójkąt z wierzchołkiem w okolicy stawu mostkowo-obojczykowego. Promienie trójkąta są osią obojczyka i linią prostą łączącą wyrostek sutkowaty ze stawem mostkowo-obojczykowym. Prostopadła zostaje przywrócona do dwusiecznej kąta ABC od środka obojczyka. Punktem przecięcia jest punkt wkłucia igły, który przesuwa się pod kątem 45° w stosunku do płaszczyzny poziomej stołu operacyjnego i prostopadle do osi odcinka szyjnego kręgosłupa. Na głębokości 2-3 cm, po otrzymaniu parestezji i przeprowadzeniu testu aspiracji, wstrzykuje się 30-40 ml 2% roztworu trimekainy (lidokainy). Znieczulenie następuje po 10-12 minutach. W przypadku uzyskania niejednoznacznej parestezji pożądane jest zastosowanie stymulacji elektrycznej do identyfikacji pnia nerwowego splotu szyjnego. 5. Znieczulenie nerwów obwodowych w okolicy nadgarstka W przypadku operacji ręki konieczne jest znieczulenie nerwu łokciowego, pośrodkowego i promieniowego. We wszystkich przypadkach igłę wstrzykuje się na poziomie proksymalnego fałdu nadgarstka. Podczas znieczulenia pacjent leży na plecach, w okolicy nadgarstka ramię jest supinowane i lekko zgięte. Charakterystyczne obiekty: styloid łokciowy, grochowaty, ścięgno zginacza nadgarstka łokciowego i ścięgno zginacza długiego nadgarstka. Znieczulenie nerwu łokciowego Topografia nerwu łokciowego. W dolnej jednej trzeciej części przedramienia nerw łokciowy przebiega bocznie od ścięgna zginacza łokciowego i przyśrodkowo od tętnicy łokciowej. Na wysokości nadgarstka lub na powierzchni zginaczy przedramienia 3-5 cm proksymalnie do nadgarstka nerw łokciowy dzieli się na dwie gałęzie - grzbietową i dłoniową. Gałąź grzbietowa jest wrażliwa, przechodzi pod ścięgno zginacza łokciowego ręki i wychodzi do tkanki podskórnej tylnej części ręki mniej więcej na poziomie stawu nadgarstkowego. Zespalając się z gałęziami nerwu promieniowego, unerwia 2 ½ palca. Gałąź dłoniowa nerwu łokciowego jest mieszana i na poziomie kości grochowatej dzieli się na dwie gałęzie - głęboką i powierzchowną. Ta ostatnia jest wrażliwa i unerwia okolice podkruchowe piątego palca i łokciową stronę palca serdecznego. Technika znieczulenia gałęzi dłoniowej nerwu łokciowego. Punkt wkłucia igły znajduje się na poziomie proksymalnego fałdu nadgarstka przyśrodkowego do ścięgna zginacza łokciowego ręki. Igłę na głębokość 1-2 cm wprowadza się przez tkankę podskórną w kierunku kości grochowatej. Po pojawieniu się parestezji i ujemnym teście aspiracji, igłę unieruchamia się i wstrzykuje 3-5 ml 2% roztworu trimekainy. W przypadku braku parestezji igłę przesuwa się do momentu zetknięcia się z kością, a po jej usunięciu nasącza się 2% roztworem trimekii do tkanek. Technika znieczulenia gałęzi grzbietowej nerwu łokciowego. Punkt wkłucia igły znajduje się na poziomie przecięcia proksymalnego fałdu nadgarstka z przyśrodkową krawędzią ścięgna zginacza łokciowego ręki. Igła skierowana jest do wyrostka rylcowatego kości łokciowej. Aby uzyskać parestezję, wstrzykuje się 3-5 ml 2% roztworu trimekainy. W przypadku braku parestezji igłę usuwa się i do tkanek wprowadza się 5-10 ml 2% roztworu trimekainy. Nie ma komplikacji. znieczulenie nerwu pośrodkowego Pacjent leży na plecach, ramię jest supinowane i wyprostowane. Charakterystyczne: ścięgno mięśnia dłoniowego długiego, ścięgno zginacza promieniowego dłoni oraz proksymalny fałd skórny nadgarstka. Topografia. W dolnej jednej trzeciej części przedramienia nerw pośrodkowy przebiega w bruździe przyśrodkowej bardzo blisko powierzchni skóry, pod powięzią i około 4-5 cm powyżej dystalnego fałdu skórnego. Bruzda środkowa jest tworzona od zewnątrz przez ścięgno zginacza promieniowego ręki, po stronie łokciowej - przez ścięgno zginacza długiego ręki. Gałęzie nerwu pośrodkowego unerwiają pierwszy, drugi, trzeci palec i zewnętrzną powierzchnię czwartego palca, a także mięśnie kłębu. Technika znieczulenia. Punkt wkłucia igły znajduje się na linii proksymalnego fałdu skórnego nadgarstka pomiędzy ścięgnem długiego mięśnia dłoniowego a zginaczem promieniowym ręki. Po prostopadłym przesunięciu igły przez tkankę podskórną na głębokość 0,5-1 cm i uzyskaniu parestezji, igłę utrwala się i wstrzykuje 3-5 ml 2% roztworu lidokainy. Jeśli nie jest możliwe uzyskanie parestezji na głębokości 1 cm, tkanki nasącza się w kształcie wachlarza 5-10 ml 2% roztworu trimekainy, powoli wyciągając igłę. Znieczulenie nerwu promieniowego Zabytki: wyrostek rylcowaty promienia, tętnica promieniowa, „tabaka anatomiczna”. Topografia. Powierzchowna gałąź nerwu promieniowego najpierw przechodzi do przedramienia wraz z tętnicą promieniową, a następnie w dolnej jednej trzeciej przedramienia w odległości około 8 cm od stawu nadgarstkowego nerw krzyżuje się ze ścięgnem mięśnia ramienno-promieniowego i przechodzi na tylną powierzchnię przedramienia, gdzie przechodzi dystalnie i do tyłu, przecinając długi odwodziciel dużego palca i jego krótki prostownik. Na wysokości nadgarstka w górnej części „tabakiery anatomicznej” dzieli się na końcowe gałęzie unerwiające palce 1, 2 i zewnętrzną powierzchnię palców 3. Gałęzie wszystkich trzech nerwów często łączą się ze sobą na przedramieniu, nadgarstku i dłoni. Technika znieczulenia. Punkt wstrzyknięcia znajduje się na poziomie proksymalnego fałdu skórnego nadgarstka, bocznie od tętnicy promieniowej, na występie wierzchołka „tabaka anatomicznej”. Gdy pojawia się parestezja, igłę unieruchamia się, z ujemnym testem aspiracyjnym wstrzykuje się 3-5 ml 2% roztworu trimekainy. W przypadku braku parestezji, 5-10 ml 2% roztworu trimekainy wstrzykuje się w kształcie wachlarza do leżących poniżej tkanek, tworząc „bransoletę” naciekową o długości 3-3,5 cm ze ścięgien krótkiego prostownika i długiego odwodziciela kciuk z jednej strony, do długiego prostownika kciuka - z drugiej. 6. Znieczulenie kończyn dolnych Aby wykonać interwencje chirurgiczne na kończynie dolnej, konieczne jest znieczulenie wszystkich czterech głównych nerwów. Trzy z nich - udowy, zasłonowy i zewnętrzny skórny uda - wywodzą się ze splotu lędźwiowego, a nerw kulszowy powstaje częściowo z lędźwiowego i trzech odgałęzień splotu krzyżowego. Każdy nerw unerwia pewne obszary kończyny dolnej: nerw udowy - przednią powierzchnię uda, przednią wewnętrzną powierzchnię podudzia i tył stopy; kulszowa - tylna i boczna powierzchnia podudzia, podeszwowa powierzchnia stopy i jej zewnętrzna krawędź, obturator - wewnętrzna powierzchnia uda; zewnętrzny nerw skórny uda - boczna powierzchnia uda. Strefy głębokiej wrażliwości pokrywają się z unerwieniem stref skóry. Wszystkie mięśnie kończyny dolnej odbierają włókna ruchowe z nerwu udowego i kulszowego, z wyjątkiem grupy odwodzicieli unerwionych przez nerw zasłonowy. Staw kolanowy i jego przednia powierzchnia są unerwione przez nerw udowy, wewnętrzną powierzchnię przez obturator, boczną przez zewnętrzne skórne i kulszowe, a tylne przez tylne nerwy skórne, udowe i kulszowe. Znieczulenie splotu lędźwiowego przez dostęp przedni (pachwinowy) Pacjent leży na plecach. Charakterystyczne obiekty: więzadło pachwinowe i tętnica udowa. Topografia. Splot lędźwiowy tworzą zespolone przednie gałęzie korzeni L.1-L2-L3 a częściowo przez przednie gałęzie Th12 i L4 nerwowość. Splot znajduje się przed wyrostkami poprzecznymi kręgów lędźwiowych między kwadratowym mięśniem dolnej części pleców - grzbietowo, mięsień lędźwiowy większy - brzusznie, ciała kręgów - przyśrodkowo, wydziela gałęzie mięśniowe i schodzi w powięzi łóżko. Nerwy kręgosłupa lędźwiowego mają gałęzie łączące z węzłami lędźwiowymi pni współczulnych, zawierają włókna nerwu ruchowego, czuciowego i współczulnego. Największymi nerwami splotu lędźwiowego jest zewnętrzny nerw skórny udowy (L2-L3), obturator (L2-L4) i kości udowej (L2-L4) nerwy. Ten ostatni jest kontynuacją splotu lędźwiowego, rozciąga się do uda pod więzadłem źrebnym przez lukę mięśniową, oddzielony od przyśrodkowej tętnicy udowej więzadłem biodrowo-odbytniczym. Szerokość nerwu udowego w tym miejscu wynosi około 0,7-0,8 cm Głębokość nerwu udowego wynosi średnio 1,8-3 cm -0,5 cm Poniżej więzadła pachwinowego nerw tworzy dwie wiązki. Gałęzie przedniego pęczka unerwiają mięsień czworogłowy uda, środkową i przyśrodkową stronę stawu kolanowego i przechodzą do nerwu odpiszczelowego, który unerwia środkową powierzchnię podudzia i wewnętrzną kostkę. Znieczulenie nerwu kulszowego umożliwia operowanie w dowolnym obszarze poniżej stawu kolanowego, w celu zmniejszenia wszystkich złamań kości kończyny dolnej, z wyłączeniem złamania szyjki kości udowej. Technika znieczulenia. Skórę traktuje się roztworem dezynfekującym. Z roztworem znieczulającym tworzy się „skórkę cytryny”, po czym igłę wstrzykuje się pod więzadło pachwinowe 1-1,5 cm poniżej tego ostatniego i 0,5-1 cm w bok od palpowanej tętnicy udowej. Igła jest prowadzona przez tkankę podskórną nieco proksymalnie pod więzadłem pachwinowym, gdzie na głębokości 3-4 cm po nakłuciu powięzi igła zawodzi z utratą oporu i może dojść do parestezji sięgającej powierzchni przedniej uda. W tej pozycji igłę mocuje się kciukiem i palcem wskazującym lewej ręki, a krawędź dłoni lewej ręki dociska siłą do tkanek miękkich uda dystalnie do igły i 35-40 ml Wstrzykuje się 1,5% roztwór trimekainy. Nacisk na tkanki miękkie trwa 1,5-2 minuty. W ten sposób znieczulenie nerwu udowego za pomocą zacisku zamienia się w znieczulenie splotu lędźwiowego, wykonywane z dostępu przedniego. Działanie znieczulenia trwa 2-2,5 godziny. Powikłania: możliwa jest dość szybka resorpcja roztworu znieczulającego, gdy znieczulenie splotu lędźwiowego łączy się ze znieczuleniem nerwu kulszowego, gdy całkowita pojedyncza dawka przekracza 1 g leku. Znieczulenie splotu lędźwiowego można wykonać z dostępu tylnego, jednocześnie znieczulając kość udową (L2-L4) i nerwy zasłonowe (L2-L3), nerw moczowo-płciowy (L1-L2) i nerwu skórnego bocznego kości udowej (L2-L3). Pozycja pacjenta podczas znieczulenia jest po zdrowej stronie ze zgiętymi nogami. Punkty orientacyjne: wyrostek kolczysty 4. kręgu lędźwiowego (linia łącząca grzebienie biodrowe z tyłu); 3 cm ogonowo wzdłuż grzbietów wyrostków kolczystych od wyrostka kolczystego 4. kręgu lędźwiowego i 5 cm w bok od ostatniego punktu. Technika znieczulenia. Z wyrostka kolczystego IV kręgu lędźwiowego w kierunku ogonowym rysuje się linię o długości 4 cm, od której końca prostopadła o długości 3 cm jest bocznie przywrócona ku górze. to punkt wstrzyknięcia igły. Po wytworzeniu „skórki cytryny” igłę o długości 5-12 cm wprowadza się prostopadle do skóry, aż do zetknięcia się z wyrostkiem poprzecznym V kręgu lędźwiowego. Czaszkowo, zsuwając się z wyrostka poprzecznego V kręgu lędźwiowego, igła wchodzi w grubość mięśnia kwadratowego lędźwiowego. Jednocześnie wyczuwalny jest opór przed wprowadzeniem do niego roztworu za pomocą strzykawki (lub sprężysty opór występuje przy deformacji pęcherzyka powietrza w strzykawce). Igłę wprowadza się na głębokość, na której występuje uczucie „utraty oporu” (lub nie deformuje się pęcherzyk powietrza). Ten test wskazuje, że igła znajduje się w powięzi między czworobocznym lędźwiowo-lędźwiowym a głównym. Igłę mocuje się na tej głębokości i wstrzykuje się 15-5 ml 5-35% roztworu trimekainy (lidokainy) w celu uzyskania znieczulenia. Możliwe powikłania: domięśniowe wstrzyknięcie roztworu znieczulenia miejscowego z niewłaściwą pozycją igły, a także szybka resorpcja środka znieczulającego do krwi po wstrzyknięciu stężonego roztworu. Znieczulenie nerwu kulszowego z dostępu przedniego Topografia. Nerw kulszowy pochodzi ze splotu krzyżowego (L4-S3). Powstaje w miednicy małej i opuszcza jamę miednicy przez otwór gruszkowaty wraz z tętnicą. W jego środkowej części przechodzi tylny nerw skórny, a także wiązka nerwowo-naczyniowa, składająca się z wewnętrznej tętnicy sromowej, żyły i nerwu sromowego. W okolicy pośladkowej nerw kulszowy leży pod mięśniem pośladkowym maksymalnym za mięśniami gemellis, obturator internus i quadratus femoris. Na tym ostatnim znajduje się w przybliżeniu w równej odległości od guzowatości kulszowej i krętarza większego kości udowej. Z reguły w górnej części dołu podkolanowego nerw dzieli się na końcowe gałęzie: nerw piszczelowy i nerw strzałkowy wspólny. Nerw piszczelowy przechodzi przez środek dołu podkolanowego, położony bocznie i powierzchownie w stosunku do żyły i tętnicy podkolanowej i wraz z naczyniami wchodzi do kanału kostkowo-podkolanowego. Nerw piszczelowy unerwia tylną grupę mięśniową podudzia, wszystkie mięśnie podeszwy stopy, skórę tylnej powierzchni podudzia, piętę i boczną krawędź stopy. Gałęzie od nerwu kulszowego do stawu biodrowego. W okolicy fałdu pośladkowego leży powierzchownie pod szeroką powięzią uda na zewnątrz długiej głowy bicepsa. Nerw strzałkowy wspólny biegnie wzdłuż bocznej strony dołu podkolanowego, wokół głowy kości strzałkowej. Z niego wychodzą gałęzie do stawu kolanowego i skóra bocznej powierzchni podudzia, unerwia również mięśnie podudzia, mięśnie grzbietu stopy i skórę tylnej części palców. Znieczulenie nerwu kulszowego wykonuje się z dostępu przedniego. Charakterystyki: przednia górna oś biodrowa i najbardziej wysunięta część krętarza większego kości udowej. Technika znieczulenia. Pacjent leży na plecach, przedni górny kręgosłup biodrowy i najbardziej wysunięty punkt krętarza większego kości udowej są połączone linią prostą, a od ostatniego punktu przywracany jest prostopadły do przedniej powierzchni uda. Długość pionu jest równa odległości między przednim górnym kolcem biodrowym a krętarzem większym kości udowej, a koniec tej pionu stanowi punkt projekcji. W pozycji fizjologicznej kończyny dolnej, po potraktowaniu skóry roztworem dezynfekującym i wytworzeniu „skórki cytryny”, igłę o długości 12-15 cm kieruje się pionowo w dół, aż oprze się o krętarz mniejszy kości udowej. Po zsunięciu się igły z krętarza mniejszego, bez zmiany kierunku głównego, igłę wprowadza się jeszcze głębiej – 4-5 cm, aż do wystąpienia parestezji. Jeśli nie jest możliwe uzyskanie parestezji, igłę powraca do kości i obracając kończynę do wewnątrz o 7-10 °, igłę przesuwa się ponownie, aż do pojawienia się parestezji u pacjenta. Znieczulenie nerwu kulszowego z dostępu tylnego Technika znieczulenia. Pacjent leży zdrowo, znieczulona kończyna jest zgięta w stawach biodrowych i kolanowych pod kątem 45-60°. Z najbardziej wysuniętej części krętarza większego kości udowej ciągnie się linię prostą do tylnego górnego kręgosłupa biodrowego, od którego środka prostopadle o długości 4-5 cm obniża się w kierunku ogonowym. jako punkt projekcyjny nerwu kulszowego. Igłę wstrzykuje się pod kątem 90° do płaszczyzny czołowej ciała pacjenta i przesuwa do momentu uzyskania parestezji lub kontaktu z kością. W razie potrzeby igłę należy wyciągnąć i wprowadzić około 0,5 cm w bok lub przyśrodku pierwotnego wstrzyknięcia. Parestezje są koniecznością. Wprowadź 20-25 ml 2% roztworu lidokainy (trimekainy). Technika znieczulenia nie zmieni się, jeśli pacjent położy się na brzuchu. Znieczulenie w dole podkolanowym W przypadku zabiegów chirurgicznych na podudziu i stopie wystarczy znieczulenie nerwu piszczelowego i strzałkowego w dole podkolanowym. Pozycja pacjenta - po zdrowej stronie lub na brzuchu. Charakterystyczne obiekty: ścięgna bicepsa, mięśnie półbłoniaste i półścięgniste uda, rzepka, mięsień łydki. Topografia. Dół podkolanowy zawiera błonnik, naczynia krwionośne, nerwy i węzły chłonne. Górna granica zewnętrzna jest utworzona przez ścięgno mięśnia dwugłowego uda, górna granica wewnętrzna jest utworzona przez ścięgna mięśnia półbłoniastego i półścięgnistego, boczna głowa mięśnia brzuchatego łydki znajduje się poniżej i na zewnątrz, a dolna wewnętrzna jest przyśrodkowa głowa mięśnia brzuchatego łydki. Rzut górnego kąta dołu podkolanowego odpowiada głównie górnej krawędzi rzepki w górnym rogu romboidalnego dołu nerwu kulszowego i jest podzielony na nerw piszczelowy i nerw strzałkowy wspólny. Ten ostatni od górnej krawędzi przechodzi do bocznej krawędzi mięśnia brzuchatego łydki i owija się wokół szyi głowy kości strzałkowej półspiralnie. W dole podkolanowym nerw piszczelowy przebiega najbardziej powierzchownie wzdłuż linii środkowej, żyła leży głębiej i przyśrodkowo od niego, a jeszcze głębiej i przyśrodkowo, bliżej kości, znajduje się tętnica podkolanowa. Technika znieczulenia. Górny róg romboidalnego dołu znajduje się na poziomie górnej krawędzi rzepki. Punkt iniekcji leży 1-1,5 cm poniżej kąta górnego na dwusiecznej opuszczonej pod tym kątem, utworzonej od zewnątrz przez ścięgno mięśnia dwugłowego uda, od wewnątrz przez ścięgna mięśnia półbłoniastego i półścięgnistego uda. Kierunek ruchu igły jest ściśle pionowy z pacjentem w pozycji leżącej, aż do uzyskania parestezji nerwu piszczelowego. W przypadku braku parestezji igła jest skierowana w kształcie wachlarza, podciągając ją za każdym razem do poziomu tkanki podskórnej. Po teście aspiracji wstrzykuje się 5-10 ml 2% roztworu trimekainy. Aby zablokować nerw strzałkowy wspólny z tego samego punktu, igłę kieruje się bocznie pod kątem 30-45° do płaszczyzny czołowej. Po otrzymaniu parestezji wstrzykuje się 5-10 ml 2% roztworu trimekainy. Nie ma komplikacji ani przeciwwskazań. Powikłania znieczulenia regionalnego Podczas RZS powikłania występują dość rzadko i można je podzielić na dwie grupy. 1. Konkretne, które są bardziej związane z błędami technicznymi metodologii: 1) błędne wstrzyknięcie środka miejscowo znieczulającego do kanału kręgowego lub przestrzeni zewnątrzoponowej dożylnie lub dotętniczo (ze znieczuleniem splotu szyjnego, znieczuleniem splotu lędźwiowego z dostępem pachwinowym); 2) nakłucie jam i narządów (jamy opłucnej, płuca); 3) powstanie krwiaka z zaniedbaniem przebicia i uszkodzenia dużego naczynia; krwiak ściska otaczającą tkankę lub wiązkę nerwowo-naczyniową; 4) przedłużone i ciężkie niedociśnienie, które występuje z szybką resorpcją znieczulenia miejscowego; 5) uraz splotu nerwowego lub przewodnika końcem igły iniekcyjnej podczas brutalnej manipulacji; 6) brak działania przeciwbólowego po znieczuleniu splotowym lub przewodzeniowym. 2. Niespecyficzny, objawiający się głównie ogólnymi i miejscowymi reakcjami organizmu na działanie znieczulenia miejscowego w postaci reakcji toksycznych i alergicznych. W zależności od czasu, dawki i miejsca podania środka znieczulającego mogą wystąpić niespecyficzne powikłania. W tym przypadku przeważają uszkodzenia ośrodkowego układu nerwowego lub sercowo-naczyniowego. Powikłania ze strony OUN mogą być łagodne (ograniczone tylko do pobudzenia ośrodkowego) lub ciężkie, co objawia się hamowaniem OUN z możliwym całkowitym porażeniem. Charakter niespecyficznych powikłań: 1) przedawkowanie środka znieczulającego z jednoczesnym podaniem dużej dawki (ponad 1 g) trimekainy lub lidokainy dotętniczo lub dożylnie. W przypadku donaczyniowego wstrzyknięcia środka miejscowo znieczulającego reakcje toksyczne pojawiają się natychmiast, a przy przedawkowaniu leku - po 10-15 minutach. Ciężkie reakcje toksyczne z nadmiernymi dawkami środków miejscowo znieczulających są niezwykle rzadkie. Znacznie częściej (aż do śmierci) obserwuje się je przy donaczyniowym podawaniu wysoce stężonego roztworu środka miejscowo znieczulającego; 2) reakcje alergiczne na wprowadzenie środka miejscowo znieczulającego, charakteryzujące się zespołem objawów zaburzeń ośrodkowego układu nerwowego i sercowo-naczyniowego: lęk, zaburzenia świadomości, zaburzenia mowy, drgania mięśni, drgawki, głębokie oddychanie, zaburzenia rytmu serca, rozszerzenie QR, obniżenie ciśnienia krwi, tachykardia, bezdech, asystolia; 3) powikłania infekcyjne z powodu złej jakości obróbki pola operacyjnego w miejscu znieczulenia, niewystarczającej sterylizacji strzykawek, igieł i roztworów, a także w obecności miejscowego zakażenia skóry (piodermii) w okolicy zamierzona manipulacja; 4) rozwój niedociśnienia przy znieczuleniu splotowym i przewodzeniowym jest znacznie rzadszy niż przy znieczuleniu zewnątrzoponowym i podpajęczynówkowym, ale nie zmniejsza to znaczenia korygowania hipowolemii; 5) wraz z wprowadzeniem stężonych roztworów środków miejscowo znieczulających w niewielkim odsetku przypadków obserwuje się rozwój bradykardii, którą dobrze zatrzymuje siarczan atropiny. Przypadki migotania komór i zatrzymania akcji serca są niezwykle rzadkie. Przeciwwskazania Przeciwwskazania są następujące. 1. Histeria. 2. Skłonność do pogorszenia. 3. Powikłania neurologiczne: porażenie połowicze i niedowład połowiczy proponowanego obszaru znieczulenia, choroby rdzenia kręgowego, stwardnienie rozsiane, choroby nerwów obwodowych. 4. Zakażenie skóry w okolicy miejsca wkłucia igły. 5. Posocznica. 6. Skłonność do krwawień i ciężka hipowolemia po masywnej utracie krwi. 7. Niedokrwistość złośliwa (przeciwwskazanie względne). 7. Znieczulenie zewnątrzoponowe Jego istotą jest blokada nerwów rdzeniowych i ich korzeni znieczuleniem wprowadzonym do przestrzeni zewnątrzoponowej. Technikę prowadzenia i strefę znieczulenia wskazano w wykładzie nr 2. Dawki i czas trwania znieczulenia 1. Lidokainę wstrzykuje się w objętości 4 ml (2%), czas trwania znieczulenia wynosi 4 godziny. 2. Marcaine podaje się w dawce 6-10 ml (0,5%), czas znieczulenia wynosi 6-8 godzin. 3. Naropin podaje się w dawce 4-6 ml (1%), czas znieczulenia wynosi 4-6 godzin. Przy tego rodzaju znieczuleniu cierpi hemodynamika, następuje gwałtowny spadek ciśnienia krwi. Dlatego przy stosowaniu tego rodzaju znieczulenia konieczne jest stałe monitorowanie ciśnienia pacjenta i, jeśli to konieczne, jego korekta. 8. Znieczulenie lędźwiowe Ten rodzaj znieczulenia uzyskuje się poprzez wstrzyknięcie środka znieczulającego do kanału kręgowego. Technika nakłucia lędźwiowego jest opisana w wykładzie nr 2. Cechą jest to, że poziom nakłucia jest wyższy (T12-L1, L1-L2) i po wyjęciu mandryny z igły natychmiast wstrzykuje się środek znieczulający. Objętość środka znieczulającego wynosi 3-5 ml. Naropin podaje się w stężeniu 0,5%, lidokainę - w 2%, marcainę - w 0,5%. Czas trwania znieczulenia wynosi 4-6 h. Ten rodzaj znieczulenia powoduje również ciężkie niedociśnienie. Z wysokim poziomem znieczulenia (T12-L1) może powodować problemy z oddychaniem. Najczęstszym powikłaniem jest ból głowy. 9. Blokada szyjki macicy według A. V. Vishnevsky'ego Pacjent kładzie się na stole na plecach tak, aby ręka po stronie proponowanej blokady wisiała nad krawędzią stołu. Mięsień mostkowo-obojczykowo-sutkowy powinien być rozluźniony. Pod obręczą barkową umieszczany jest wałek, głowa jest cofana w przeciwnym kierunku; w tej pozycji dobrze zarysowane są anatomiczne kontury szyi. Pole jest traktowane smarowaniem alkoholem i jodem. Lekarz stoi po stronie blokady o tej samej nazwie. Miejsce wstrzyknięcia to kąt utworzony przez przecięcie żyły tylnej krawędzi mięśnia mostkowo-obojczykowo-sutkowego. Palec wskazujący lewej ręki umieszcza się na tylnej krawędzi mięśnia mostkowo-obojczykowo-sutkowego, powyżej miejsca jego przecięcia z żyłą szyjną zewnętrzną. Mocno naciskając palec na to miejsce, próbują przesunąć wiązkę nerwowo-naczyniową do linii środkowej. W takim przypadku palec łatwo wyczuwa przednią powierzchnię kręgów szyjnych. Wstrzykiwanie igły i jej wsuwanie powinno odbywać się powoli, w górę i do wewnątrz, cały czas skupiając się na przedniej powierzchni kręgosłupa. Igła porusza się wzdłuż 2% roztworu nowokainy przesyłanego małymi porcjami (3-0,25 cm), co zapewnia bezpieczeństwo wstrzyknięcia. Strzykawka podczas wstrzykiwania jest wielokrotnie wyjmowana z igły w celu kontroli (krew). Po przyłożeniu igły do kręgu czują, jak się o nią opiera. Następnie nacisk na igłę ulega osłabieniu, dzięki czemu odsuwa się ona o 1-2 mm, po czym wstrzykuje się 40 do 60 ml roztworu, który rozprzestrzeniając się pełzającym naciekiem wzdłuż rozcięgna przedkręgowego, pokrywa błędny, współczulny , a często nerwy przeponowe, przerywające (blokujące) przenoszenie podrażnień z okolicy opłucnej. O skuteczności blokady wagosympatycznej świadczy pojawienie się objawu Hornera (zwężenie źrenicy, zwężenie szpary powiekowej i cofnięcie gałki ocznej). Rytm oddechowy i puls stają się rzadsze, zmniejsza się duszność i sinica, poprawia się stan ogólny. Aby uniknąć wkłucia igły w naczynia szyi, mięsień mostkowo-obojczykowo-sutkowy wraz z leżącym poniżej pęczkiem nerwowo-naczyniowym powinien być wystarczająco mocno przesunięty palcem wskazującym do linii środkowej. Ważne jest, aby skierować igłę do góry i do wewnątrz, ponieważ przesuwanie jej w kierunku poziomym grozi wprowadzeniem rozwiązania pod rozcięgno przedkręgowe i późniejsze powikłanie w postaci zespołu bólowego, który nie ustaje w ciągu dnia. Wykład nr 14. Ocena zaawansowania stanu pacjenta i monitorowanie Ocena stanu somatycznego pacjenta. 1 punkt - pacjenci, których choroba jest zlokalizowana i co do zasady nie powoduje zaburzeń ogólnoustrojowych, czyli praktycznie ludzie zdrowi. 2 punkty - obejmuje to pacjentów z niewyrażonymi zaburzeniami, które umiarkowanie zakłócają życiową aktywność organizmu bez wyraźnych zmian homeostazy. 3 punkty - pacjenci z życiowymi zaburzeniami ogólnoustrojowymi, które znacząco zakłócają funkcjonowanie organizmu, ale nie prowadzą do niepełnosprawności. 4 punkty - pacjenci z ciężkimi zaburzeniami ogólnoustrojowymi, które stanowią duże zagrożenie dla życia ludzkiego i prowadzą do niepełnosprawności. 5 punktów - pacjenci, których stan uznano za krytyczny, ryzyko zgonu w ciągu 24 godzin jest wysokie. Wielkość i charakter interwencji chirurgicznej: 1 punkt - małe operacje za: usunięcie guzów położonych powierzchownie i zlokalizowanych, otwarcie małych ropni, amputację palców rąk i nóg, podwiązanie i usunięcie hemoroidów, nieskomplikowaną wyrostek robaczkowy i przepukliny. 2 punkty - operacje o umiarkowanym nasileniu: usunięcie powierzchownie zlokalizowanych nowotworów złośliwych wymagających przedłużonej interwencji; otwarcie ropni zlokalizowanych w jamach; amputacja i dezartykulacja kończyn górnych i dolnych; operacje na naczyniach obwodowych; skomplikowane wycięcie wyrostka robaczkowego i przepukliny wymagające rozległej interwencji; próbna torakotomia i laparotomia; inne podobne pod względem złożoności i zakresu interwencji. 3 punkty - rozległe interwencje chirurgiczne: radykalne operacje na narządach jamy brzusznej (z wyjątkiem wymienionych powyżej); radykalne operacje na narządach jamy klatki piersiowej; rozszerzone amputacje kończyn, takie jak amputacja transiliosakralna; Operacja mózgu. 4 punkty - operacje na sercu, duże naczynia i inne złożone interwencje wykonywane w specjalnych warunkach (sztuczne krążenie, hipotermia itp.). Doraźne interwencje chirurgiczne są oceniane, podobnie jak planowane, w zależności od stanu fizycznego i objętości operacji, ale są one ujęte w osobnej grupie lub oznaczone oprócz cyfry indeksem „C”. Operacja Ryzyko operacyjne i anestezjologiczne oznacza się następująco: licznik wskazuje w punktach zaawansowanie stanu wyjściowego, w mianowniku objętość operacji, również w punktach. Klasyfikacja obiektywnego statusu pacjenta, opracowana przez Amerykańskie Towarzystwo Anestezjologów (ASA). 1. Nie ma zaburzeń ogólnoustrojowych. 2. Łagodne zaburzenia ogólnoustrojowe bez upośledzenia czynnościowego. 3. Umiarkowane i ciężkie choroby ogólnoustrojowe z dysfunkcją. 4. Ciężka choroba ogólnoustrojowa, stale zagrażająca życiu i prowadząca do niewydolności funkcji. 5. Stan terminalny, wysokie ryzyko śmierci w ciągu dnia, niezależnie od operacji. 6. Śmierć mózgu, dawstwo narządów do przeszczepu. Jeżeli interwencja jest przeprowadzana w trybie nagłym, ocenę stanu uzupełnia litera „E”. Ocenę stanu pacjenta i możliwą śmiertelność każdego przypadku przedstawiono w tabeli 7. Tabela 7 Ocena stanu pacjenta i śmiertelności okołooperacyjnej
Monitorowanie (tab. 7) to kontrola funkcji i procesów, identyfikacja ich niebezpiecznych odchyleń w celu zapobiegania powikłaniom, w szczególności podczas znieczulenia i intensywnej terapii. Monitoring przeprowadzany jest w celu kontroli: 1) dla funkcji pacjenta (elektrokardiografia, pulsoksymetria, kapnografia itp.); 2) działania terapeutyczne (kontrola blokady nerwowo-mięśniowej); 3) środowisko (skład gazu wdychanej mieszaniny); 4) eksploatacja środków technicznych (wentylator itp.). Monitorowanie funkcji według stopnia złożoności może być realizowane poprzez: 1) ciągłe monitorowanie parametrów; 2) kontrola z sygnalizacją przekroczenia ustalonych granic parametru; 3) ciągły monitoring z powiadomieniem, gdy parametr przekroczy ustalone limity oraz dodatkowo podpowiedź rozwiązania; 4) to samo z realizacją działań normalizujących funkcję. Znaczenie monitorowania wynika z: 1) coraz większa złożoność i czas trwania interwencji chirurgicznych; 2) wzrost nasilenia zaburzeń czynnościowych u pacjentów; 3) skomplikowanie środków technicznych stosowanych w medycynie krytycznej. Znaczenie monitoringu: 1) terminowa diagnoza zaburzeń i zapobieganie poważnym powikłaniom, w tym zatrzymaniu krążenia i oddychania; 2) bardziej adekwatna taktyka intensywnej terapii i wysoka skuteczność leczenia. Wskazania kontrolne: 1) minimalny monitoring – zawsze obowiązkowy podczas znieczulenia i intensywnej terapii; 2) pogłębiony monitoring (metody nieinwazyjne i inwazyjne) w przypadku istotnych naruszeń funkcji organizmu, zwłaszcza gdy u pacjenta rozwinie się niewydolność wielonarządowa; 3) monitoring prewencyjny – w przypadku ryzyka wystąpienia stanu krytycznego. Standardy monitorowania. W 1978 roku Holenderska Rada Zdrowia wprowadziła pierwszy standard monitorowania sal operacyjnych, który wymieniał sprzęt potrzebny do monitorowania. W 1985 roku, z sugestii towarzystw ubezpieczeniowych, zaproponowano harwardzki standard monitorowania dla anestezjologii, który określa parametry monitorowania pacjentów podczas znieczulenia podczas operacji oraz tryb takiego monitorowania. Jego wprowadzenie do praktyki zmniejszyło ryzyko powikłań anestezjologicznych i uczyniło go bezpieczniejszym dla pacjenta. W Rosji w 1997 r. system MORF określił standardy minimalnego monitorowania znieczulenia, resuscytacji i intensywnej terapii (nr 161/DM-2 z 24 lutego 1997 r. „W sprawie środków zapewniających bezpieczeństwo pacjentów podczas znieczulenia, resuscytacji i intensywnej terapii” ). Dane przedstawiono w tabeli 8, tabeli 9. Tabela 8 znieczulenie
Tabela 9 Prowadzenie resuscytacji i intensywnej terapii
Do prowadzenia skutecznej intensywnej terapii konieczne jest monitorowanie układu krążenia, oddechowego i nerwowego, funkcji wątroby, nerek, przewodu pokarmowego, hematopoezy, hemostazy, a także energii, wodno-elektrolitowej, kwasowo-zasadowej i onkoosmotycznej saldo. Równie ważne jest intensywne monitorowanie trwających interwencji terapeutycznych i ich wyników. Ważną rolę odgrywa monitorowanie zewnętrznego i wewnętrznego stanu mikrobiologicznego oraz stosowanie kryteriów prognostycznych i oceny wyników. Przede wszystkim konieczne jest zastosowanie klinicznej oceny stanu pacjenta oraz nieinwazyjnych metod monitorowania. Monitorowanie kliniczne, czyli obserwacja objawów klinicznych, dane jakościowe, jest nie mniej ważne niż wskaźniki ilościowe uzyskiwane przy użyciu zaawansowanej technologii. Monitorowanie funkcji systemu Monitorowanie układu krążenia Monitorowanie krążenia zapewnia szybkie wykrywanie arytmii serca i niedokrwienia mięśnia sercowego za pomocą elektrokardiografii. Zaburzenia rytmu serca można rozpoznać na podstawie załamka P i kompleksu ORS na elektrokardiomonitorze w odprowadzeniach V1 i V2 standardowego odprowadzenia z kończyn lub ich modyfikacji. Niedokrwienie mięśnia sercowego można zidentyfikować na podstawie powstałego obniżenia odcinka ST na EKG: 1) w odprowadzeniu klatki piersiowej V5, a także na jednej z jej modyfikacji - niedokrwienie przegrody lewej ściany bocznej; 2) standardowe 2 odprowadzenia z kończyn - niedokrwienie strefy podstawnej mięśnia sercowego w dorzeczu prawej tętnicy wieńcowej. Opadające obniżenie ST (uniesienie) jest wskaźnikiem niedokrwienia wywołanego stresem. Monitorowanie hemodynamiki prowadzone jest przez: 1) pomiary ciśnienia krwi; 2) pomiary CVP w połączeniu z testami wysiłkowymi wolumetrycznymi (jest to informacja o wypełnieniu naczyń); 3) określenie ciśnienia w tętnicy płucnej i ciśnienia zaklinowania (PWP) za pomocą pływającego cewnika w tętnicy płucnej jest dokładniejszą metodą oceny objętości wewnątrznaczyniowej niż CVP i może również służyć jako miara obciążenia wstępnego lewej komory; 4) określenie rzutu serca techniką termodylucji metodą Ficka (CO = VCO2 /CaCO2), różne modyfikacje techniki Dopplera (echokardiografia dopplerowska przełyku), USG serca. Monitorowanie oddechu Monitorowanie oddechu odbywa się zgodnie z objawami klinicznymi i danymi kapnografii, pulsoksymetrii, spirometrii objętościowej i okresowego gazometrii. Podczas wentylacji mechanicznej ciśnienie w układzie „wentylator – pacjent” oraz stężenie tlenu w mieszaninie wziewnej (FiO2). Kliniczne objawy niewydolności oddechowej: częste (powyżej 24-30 na minutę u dorosłych) płytki oddech, udział w oddychaniu dodatkowych mięśni (mostkowo-obojczykowo-sutkowych, brzucha i innych, objawiający się cofaniem przestrzeni międzyżebrowych, obrzękiem skrzydeł nos, wymuszona pozycja półsiedząca), pocenie się, sinica, zmiana częstości akcji serca (pierwszy wzrost, potem może wystąpić arytmia) i ciśnienia krwi (wzrost, a przy ciężkim niedotlenieniu - spadek), zmiana świadomości z euforii na śpiączka. Kapnografia umożliwia szybkie wykrycie zaburzeń wentylacji: hipowentylacja (zwiększony CO2 w końcowym wydychanym powietrzu - FetCO2 > 6,4%, hiperwentylacja (FetCO2 < 4,9%, nierówna wentylacja (kąt nachylenia plateau kapnogramu wyrostka zębodołowego - 5°). Podczas wentylacji mechanicznej, jeśli nie ma kapnografu, objętość wentylacji jest kontrolowana przez objętość minutową oddychania (Vist.), mierzoną za pomocą spirometru wolumetrycznego, który jest zainstalowany na drodze wydechowej. Dodatkowo monitorowana jest minutowa objętość wdechowa (Vapar.), która jest niezbędna do obliczenia stężenia tlenu we wdychanej mieszaninie gazów oraz określenia szczelności tego układu – „wentylator-pacjent”. Kontrolę szczelności uzyskuje się również poprzez ciśnienie w układzie „urządzenie-sick” mierzone za pomocą monowakuometru. Pulsoksymetria umożliwia szybkie wykrycie upośledzenia utlenowania płuc, hipoksemii (SaO2 < 94%. Ponadto na podstawie charakteru pletyzmogramu można ocenić stan mikrokrążenia i rzutu serca. Dodatkowe badanie gazometrii pomaga ocenić stopień upośledzonej wymiany gazowej w płucach (przez wielkość pęcherzykowo-tętniczego gradientu prężności tlenu. Niektóre monitory mogą zapewnić ocenę biomechaniki oddychania podczas wentylacji mechanicznej na podstawie podatności płuc i klatki piersiowej (C, normalnie 60-100 ml) oraz oporem (oporem) dróg oddechowych (R, normalnie 2-3 cm). Monitorowanie funkcji neurologicznych Monitorowanie funkcji neurologicznych odbywa się poprzez ocenę świadomości w skali Glasgow (na podstawie reakcji otwarcia oczu, reakcji motorycznych i werbalnych na narastający bodziec: 15 pkt – normalny, 3 pkt – śmierć mózgu). Ponadto określa się ciśnienie śródczaszkowe i mózgowy przepływ krwi (na przykład za pomocą przezczaszkowego monitora dopplerowskiego). Czynność nerek najczęściej monitoruje się, mierząc godzinową wydalanie moczu, która zwykle wynosi > 0,5 ml/kg/h. Wykład nr 15. Sztuczna wentylacja płuc Sztuczna wentylacja płuc (ALV) zapewnia wymianę gazową między otaczającym powietrzem (lub pewną mieszaniną gazów) a pęcherzykami płucnymi, stosowana jest jako środek resuscytacji w przypadku nagłego zaprzestania oddychania, jako składnik znieczulenia oraz jako środek intensywnej opieki w przypadku ostrej niewydolności oddechowej, a także niektórych chorób układu nerwowego i mięśniowego. Współczesne metody sztucznej wentylacji płuc (ALV) można podzielić na proste i sprzętowe. Prostą metodę wentylacji mechanicznej stosuje się zwykle w sytuacjach nagłych (bezdech, z nieprawidłowym rytmem, oddychanie agonalne, z narastającą hipoksemią i (lub) hiperkapnią oraz ciężkimi zaburzeniami metabolicznymi). Metody wydechowe IVL (sztuczne oddychanie) z ust do ust i z ust do nosa są proste. W razie potrzeby do długotrwałej wentylacji mechanicznej (od godziny do kilku miesięcy, a nawet lat) stosuje się metody sprzętowe. Respirator Phase-50 ma ogromny potencjał. Do praktyki pediatrycznej produkowany jest aparat „Vita-1”. Respirator jest podłączony do dróg oddechowych pacjenta przez rurkę dotchawiczą lub kaniulę tracheostomijną. Wentylacja sprzętowa odbywa się w trybie normalnej częstotliwości, która wynosi od 12 do 20 cykli na 1 minutę. W praktyce występuje wentylacja mechaniczna w trybie wysokiej częstotliwości (powyżej 60 cykli na 1 min), w której objętość oddechowa wyraźnie spada (do 150 ml lub mniej), dodatnie ciśnienie w płucach pod koniec wdechu spada, jak również ciśnienie w klatce piersiowej i poprawia się przepływ krwi do serca. Ponadto w trybie wysokiej częstotliwości ułatwiona jest adaptacja pacjenta do respiratora. Istnieją trzy metody wentylacji wysokiej częstotliwości: wolumetryczna, oscylacyjna i strumieniowa. Objętość jest zwykle przeprowadzana z częstością oddechów 80-100 na 1 min, oscylacyjnym IVL - 600-3600 na 1 min, co zapewnia wibracje ciągłego lub przerywanego przepływu gazu. Najbardziej rozpowszechniona wentylacja strumieniowa o wysokiej częstotliwości z częstością oddechów 100-300 na minutę, w której strumień tlenu o ciśnieniu 1-2 atm jest wdmuchiwany do dróg oddechowych przez igłę lub cewnik o średnicy 2-4 mm. Wentylacja strumieniowa odbywa się przez rurkę dotchawiczą lub tracheostomię (jednocześnie do dróg oddechowych zasysane jest powietrze atmosferyczne) oraz przez cewnik wprowadzany do tchawicy przez kanał nosowy lub przezskórnie (nakłucie). To ostatnie ma znaczenie w sytuacjach, gdy nie ma warunków do intubacji tchawicy. Sztuczną wentylację płuc można przeprowadzić w trybie automatycznym, ale jest to dopuszczalne w przypadkach, gdy spontaniczny oddech pacjenta jest całkowicie nieobecny lub stłumiony przez leki farmakologiczne (środki zwiotczające mięśnie). Przeprowadzana jest również wentylacja wspomagana, ale w tym przypadku zachowane jest niezależne oddychanie pacjenta. Gaz podawany jest po wykonaniu przez pacjenta słabej próby wdechu lub po zsynchronizowaniu pacjenta z indywidualnie wybranym trybem pracy urządzenia. Istnieje również tryb przerywanej wentylacji wymuszonej (PMV), który jest stosowany podczas stopniowego przechodzenia od wentylacji mechanicznej do oddychania spontanicznego. W takim przypadku pacjent oddycha samodzielnie, ale dodatkowo do dróg oddechowych dostarczany jest ciągły przepływ mieszaniny gazów. Na tym tle, z określoną częstotliwością (od 10 do 1 raz na minutę), urządzenie wykonuje sztuczny oddech, zbieżny (zsynchronizowany PVL) lub niezgodny (niezsynchronizowany PVL) z niezależnym wdechem pacjenta. Stopniowa redukcja sztucznych oddechów pozwala przygotować pacjenta do oddychania spontanicznego. Obwody oddechowe przedstawiono w Tabeli 10. Tabela 10 Obwody oddechowe
Ręczna wentylacja za pomocą worka lub maski jest łatwo dostępna i często wystarcza do odpowiedniego napełnienia płuc. O jego sukcesie z reguły decyduje prawidłowy dobór rozmiaru maski i doświadczenie operatora, a nie nasilenie patologii płuc. Wskazania 1. Resuscytacja i przygotowanie pacjenta w krótkim czasie do kolejnej intubacji. 2. Okresowa wentylacja za pomocą worka i maski, aby zapobiec niedodmie poekstubacyjnej. 3. Ograniczenia wentylacji za pomocą worka i maski. Sprzęt Stosuje się konwencjonalny worek oddechowy i maskę z zainstalowanym manometrem lub samopompujący się worek oddechowy z komorą tlenową. Technika z 1. Konieczne jest ścisłe przyleganie maski do twarzy pacjenta, ustawiając głowę pacjenta w pozycji środkowej z unieruchomionym palcem podbródkiem. Maska nie powinna leżeć na oczach. 2. Częstość oddechów - zwykle 30-50 na 1 min. 3. Ciśnienie wdechowe - zwykle 20-30 cm wody. Sztuka. 4. Większe ciśnienie (30-60 cm słupa wody) jest dopuszczalne podczas resuscytacji pierwotnej w aktywności zawodowej kobiety. Ocena wydajności 1. Powrót tętna do wartości prawidłowych i zniknięcie sinicy centralnej. 2. Ruch klatki piersiowej powinien być dobry, oddychanie odbywa się równie dobrze po obu stronach. 3. Badanie składu gazu we krwi jest zwykle wymagane i przeprowadzane podczas długotrwałej resuscytacji. Komplikacje 1. Odma opłucnowa. 2. Wzdęcia. 3. Zespół hipowentylacji lub epizody bezdechu. 4. Podrażnienie skóry twarzy. 5. Odwarstwienie siatkówki (podczas nakładania maski na oczy i tworzenia długotrwałego wysokiego ciśnienia szczytowego). 6. Wentylacja przez maskę i worki może pogorszyć stan pacjenta, jeśli aktywnie opiera się on zabiegowi. Sprzęt IVL Wskazania 1. Bezdech. 2. Śpiączka w ostrym okresie, nawet bez oznak niewydolności oddechowej. 3. Napady niekontrolowane standardową terapią przeciwdrgawkową. 4. Szok o dowolnej etiologii. 5. Wzrost dynamiki zespołu depresji OUN w zespole hiperwentylacji. 6. Przy porodzie uraz kręgosłupa u noworodków - pojawienie się wymuszonego oddychania i trzeszczącego rozległego świszczącego oddechu na tle duszności. 7. RO2 krew włośniczkowa poniżej 50 mm Hg. Sztuka. podczas oddychania spontanicznego mieszaniną z FiO2 0,6 lub więcej. 8. RSO2 krew włośniczkowa powyżej 60 mm Hg. Sztuka. lub mniej niż 35 mm Hg. Sztuka. ze spontanicznym oddychaniem. Wyposażenie: „FAZA-5”, „BP-2001”, „Infant-Star 100 lub 200”, „Sechrist 100 lub 200”, „Babylog 1”, „Stephan” itp. Zasady leczenia 1. Natlenienie w sztywnych płucach można osiągnąć poprzez zwiększenie stężenia wdychanego tlenu, zwiększenie ciśnienia wdechowego, zwiększenie PEEP, wydłużenie czasu wdechu, zwiększenie ciśnienia plateau. 2. Wentylacja (usuwanie CO2) można zwiększyć poprzez zwiększenie objętości oddechowej, zwiększenie częstotliwości i wydłużenie czasu wydechu. 3. Dobór parametrów wentylacji (częstotliwość, ciśnienie wdechowe, plateau wdechu, stosunek wdech-wydech, PEEP) będzie się różnić w zależności od charakteru choroby podstawowej i odpowiedzi pacjenta na terapię. Cele IVL 1. Tlen: osiągnij pO2 50-100 mmHg Sztuka. 2. Trzymaj pCO2 w granicach 35-45 mm Hg. Sztuka. 3. Wyjątki: w niektórych sytuacjach wskaźniki pO2 i pCO2 może różnić się od powyższych: 1) w przewlekłej patologii płuc wyższe wartości pCO2 przenośny; 2) przy ciężkich wadach serca tolerowane są mniejsze liczby pO2; 3) w zależności od podejścia terapeutycznego w przypadku nadciśnienia płucnego tolerowane są większe lub mniejsze wartości pCO2. 4. Wskazania i parametry wentylacji należy zawsze dokumentować. Technika z 1. Początkowe parametry IVL: ciśnienie wdechowe 20-24 cm wody. Sztuka.; PEER od 4-6 cm wody. Sztuka.; częstość oddechów 16-24 na 1 min, czas inhalacji 0,4-0,6 s, DO od 6 do 10 l/min, MOV (objętość wentylacji minutowej) 450-600 ml/min. 2. Synchronizacja z respiratorem. Z reguły pacjenci są zsynchronizowani z respiratorem. Ale podniecenie może zaburzać synchronizację, w takich przypadkach może być wymagana terapia lekowa (morfina, promedol, hydroksymaślan sodu, środki zwiotczające mięśnie). Ankieta 1. Ważnym elementem ankiety są powtórne badania gazometrii. 2. Badanie fizykalne. Kontrola adekwatności IVL. Wykonując wentylację ratunkową prostą metodą wystarczy obserwować kolor skóry i ruchy klatki piersiowej pacjenta. Ściana klatki piersiowej powinna rozszerzać się z każdym wdechem i opadać z każdym wydechem, ale jeśli obszar nadbrzusza unosi się, wdmuchiwane powietrze dostaje się do przełyku i żołądka. Powodem jest często niewłaściwa pozycja głowy pacjenta. Prowadząc długotrwałą wentylację mechaniczną, należy ocenić jej adekwatność. Jeśli spontaniczne oddychanie pacjenta nie jest tłumione przez preparaty farmakologiczne, wówczas jednym z głównych objawów adekwatności wykonanego IVL jest dobra adaptacja pacjenta do respiratora. W obecności jasnej świadomości pacjent nie powinien odczuwać braku powietrza, dyskomfortu. Odgłosy oddechowe w płucach powinny być takie same po obu stronach, a skóra powinna mieć normalny kolor. Komplikacje 1. Najczęstszymi powikłaniami wentylacji mechanicznej są: pęknięcie pęcherzyków płucnych z rozwojem rozedmy śródmiąższowej, odma opłucnowa i odma śródpiersia. 2. Innymi powikłaniami mogą być: zakażenie i infekcja bakteryjna, obturacja rurki dotchawiczej lub ekstubacja, intubacja jednego płuca, zapalenie osierdzia z tamponadą serca, zmniejszony powrót żylny i zmniejszony rzut serca, przewlekłość procesu w płucach, zwężenie i niedrożność tchawica. Na tle wentylacji mechanicznej możliwe jest zastosowanie szeregu leków przeciwbólowych, które powinny zapewnić wystarczający poziom i głębokość znieczulenia w dawkach, których wprowadzeniu w warunkach oddychania spontanicznego towarzyszyłaby hipoksemia. Wentylacja mechaniczna, utrzymując dobry dopływ tlenu do krwi, przyczynia się do tego, że organizm radzi sobie z urazem chirurgicznym. W wielu operacjach narządów klatki piersiowej (płuca, przełyk) stosuje się oddzielną intubację oskrzeli, co umożliwia odłączenie jednego płuca od wentylacji podczas zabiegów chirurgicznych w celu ułatwienia pracy chirurga. Intubacja zapobiega również przeciekaniu zawartości operowanego płuca do zdrowego płuca. Podczas operacji na krtani i drogach oddechowych stosuje się przezcewnikową wentylację strumieniową o wysokiej częstotliwości, która ułatwia badanie pola operacyjnego i pozwala na utrzymanie odpowiedniej wymiany gazowej przy otwartych tchawicy i oskrzelach. W warunkach znieczulenia ogólnego i zwiotczenia mięśni pacjent nie jest w stanie zareagować na powstałe niedotlenienie i hipowentylację, dlatego ważne jest kontrolowanie gazometrii (ciągłe monitorowanie ciśnienia parcjalnego tlenu i ciśnienia parcjalnego dwutlenku węgla) drogą przezskórną za pomocą specjalnych czujników. W przypadku śmierci klinicznej lub agonii wentylacja mechaniczna jest obowiązkowym elementem resuscytacji. Możliwe jest zaprzestanie wykonywania IVL dopiero po całkowitym przywróceniu świadomości i zakończeniu spontanicznego oddychania. W kompleksie intensywnej terapii wentylacja mechaniczna jest najskuteczniejszą metodą leczenia ostrej niewydolności oddechowej. Odbywa się to przez rurkę, którą wprowadza się do tchawicy przez dolny kanał nosowy lub tracheostomię. Szczególnie ważna jest pielęgnacja dróg oddechowych, ich odpowiedni drenaż. Pomocniczą wentylację mechaniczną stosuje się w sesjach trwających 30-40 minut w leczeniu pacjentów z przewlekłą niewydolnością oddechową. IVL stosuje się u pacjentów w stanie śpiączki (uraz, operacja mózgu), a także z obwodowym uszkodzeniem mięśni oddechowych (zapalenie wielokorzeniowe, uszkodzenie rdzenia kręgowego, stwardnienie zanikowe boczne). ALV jest również szeroko stosowany w leczeniu pacjentów po urazach klatki piersiowej, różnych zatruciach, udarach mózgowo-naczyniowych, tężcu i zatruciu jadem kiełbasianym. Wykład nr 16. Terapia infuzyjna Terapia infuzyjna to wstrzyknięcie kroplowe lub wlew dożylny lub podskórny leków i płynów biologicznych w celu normalizacji równowagi wodno-elektrolitowej, kwasowo-zasadowej organizmu, a także wymuszonej diurezy (w połączeniu z diuretykami). Wskazania do terapii infuzyjnej: wszelkiego rodzaju wstrząsy, utrata krwi, hipowolemia, utrata płynów, elektrolitów i białek w wyniku nieustępliwych wymiotów, intensywnej biegunki, odmowy przyjmowania płynów, oparzeń, choroby nerek; naruszenia zawartości jonów zasadowych (sodu, potasu, chloru itp.), kwasicy, zasadowicy i zatrucia. Główne oznaki odwodnienia organizmu: cofanie gałek ocznych do oczodołów, matowa rogówka, sucha, nieelastyczna skóra, charakterystyczne kołatanie serca, skąpomocz, mocz staje się skoncentrowany i ciemnożółty, stan ogólny jest przygnębiony. Przeciwwskazaniami do terapii infuzyjnej są ostra niewydolność sercowo-naczyniowa, obrzęk płuc i bezmocz. Roztwory krystaloidów są w stanie zrekompensować niedobór wody i elektrolitów. Nanieść 0,85% roztwór chlorku sodu, roztwory Ringera i Ringera-Locke'a, 5% roztwór chlorku sodu, 5-40% roztwory glukozy i inne roztwory. Podaje się je dożylnie i podskórnie, strumieniem (z silnym odwodnieniem) i kroplówką, w objętości 10-50 ml/kg lub większej. Rozwiązania te nie powodują powikłań, z wyjątkiem przedawkowania. Cele terapii infuzyjnej to: przywrócenie BCC, eliminacja hipowolemii, zapewnienie odpowiedniej pojemności minutowej serca, utrzymanie i przywrócenie prawidłowej osmolarności osocza, zapewnienie odpowiedniego mikrokrążenia, zapobieganie agregacji krwinek, normalizacja funkcji transportu tlenu przez krew. Roztwory koloidalne to roztwory substancji wielkocząsteczkowych. Przyczyniają się do zatrzymania płynu w łożysku naczyniowym. Stosuje się Hemodez, poliglucynę, reopoliglyukin, reogluman. Wraz z ich wprowadzeniem możliwe są powikłania, które objawiają się w postaci reakcji alergicznej lub pirogennej. Drogi podania - dożylnie, rzadziej podskórnie i kroplówka. Dzienna dawka nie przekracza 30-40 ml/kg. Mają właściwości odtruwające. Jako źródło żywienia pozajelitowego stosuje się je w przypadku przedłużającej się odmowy jedzenia lub niemożności karmienia doustnie. Stosowane są hydrolizyny krwi i kazeiny (alvezin-neo, poliamina, lipofundin itp.). Zawierają aminokwasy, lipidy i glukozę. Czasami pojawia się reakcja alergiczna na wprowadzenie. Szybkość i objętość infuzji. Wszystkie wlewy pod względem szybkości wlewu wolumetrycznego można podzielić na dwie kategorie: wymagające i niewymagające szybkiej korekty niedoboru BCC. Głównym problemem mogą być pacjenci, którzy potrzebują szybkiej eliminacji hipowolemii. tj. szybkość wlewu i jego objętość muszą zapewniać pracę serca, aby prawidłowo zaopatrywać regionalną perfuzję narządów i tkanek bez znaczącej centralizacji krążenia krwi. U pacjentów z początkowo zdrowym sercem najbardziej pouczające są trzy kliniczne cechy charakterystyczne: średnie BP > 60 mm Hg. Sztuka.; centralne ciśnienie żylne - CVP > 2 cm wody. Sztuka.; diureza 50 ml/h. W wątpliwych przypadkach przeprowadza się test z obciążeniem objętościowym: 15-20 ml roztworu krystaloidu wlewa się przez 400-500 minut i obserwuje się dynamikę CVP i diurezę. Znaczący wzrost CVP bez wzrostu diurezy może wskazywać na niewydolność serca, co sugeruje potrzebę bardziej złożonych i pouczających metod oceny hemodynamiki. Utrzymywanie obu odczytów na niskim poziomie sugeruje hipowolemię, a następnie utrzymywanie dużej szybkości wlewu z powtarzaną oceną krok po kroku. Wzrost diurezy wskazuje na skąpomocz przednerkowy (hipoperfuzja nerek pochodzenia hipowolemicznego). Terapia infuzyjna u pacjentów z niewydolnością krążenia wymaga jasnej znajomości hemodynamiki, dużego i specjalnego monitorowania monitorów. Dekstransy to koloidalne substytuty osocza, co czyni je wysoce skutecznymi w szybkim odzyskiwaniu BCC. Dekstransy mają specyficzne właściwości ochronne przed chorobami niedokrwiennymi i reperfuzją, których ryzyko jest zawsze obecne podczas dużych zabiegów chirurgicznych. Negatywne aspekty dekstranów obejmują ryzyko krwawienia z powodu dezagregacji płytek krwi (szczególnie charakterystycznej dla reopolyglucyny), gdy konieczne staje się zastosowanie znacznych dawek leku (>20 ml/kg) oraz przejściowa zmiana właściwości antygenowych krew. Dekstransy są niebezpieczne ze względu na ich zdolność do wywoływania „oparzenia” nabłonka kanalików nerkowych i dlatego są przeciwwskazane w niedokrwieniu nerek i niewydolności nerek. Często powodują reakcje anafilaktyczne, które mogą być dość poważne. Szczególnie interesujący jest roztwór albuminy ludzkiej, jako naturalnego koloidu substytutu osocza. W wielu stanach krytycznych, którym towarzyszy uszkodzenie śródbłonka (przede wszystkim we wszystkich ogólnoustrojowych chorobach zapalnych), albumina jest w stanie przedostać się do przestrzeni międzykomórkowej łożyska pozanaczyniowego, przyciągając wodę i nasilając obrzęk tkanek śródmiąższowych, przede wszystkim płuc. Świeżo mrożone osocze to produkt pobierany od jednego dawcy. FFP oddziela się od krwi pełnej i zamraża natychmiast w ciągu 6 godzin od pobrania krwi. Przechowywany w 30°C w plastikowych torebkach przez 1 rok. Biorąc pod uwagę labilność czynników krzepnięcia, FFP należy podawać w ciągu pierwszych 2 godzin po szybkim rozmrożeniu w temperaturze 37°C. Transfuzja świeżo mrożonego osocza (FFP) stwarza wysokie ryzyko zarażenia groźnymi infekcjami, takimi jak HIV, wirusowe zapalenie wątroby typu B i C itp. Częstość reakcji anafilaktycznych i pirogennych podczas przetaczania FFP jest bardzo wysoka, więc zgodność zgodna z systemem ABO należy wziąć pod uwagę. A w przypadku młodych kobiet należy wziąć pod uwagę zgodność Rh. Obecnie jedynym bezwzględnym wskazaniem do stosowania FFP jest zapobieganie i leczenie krwawień koagulopatycznych. FFP spełnia jednocześnie dwie ważne funkcje - hemostatyczną i utrzymującą ciśnienie onkotyczne. FFP jest również przetaczany z hipokoagulacją, z przedawkowaniem pośrednich antykoagulantów, z terapeutyczną plazmaferezą, z ostrym DIC oraz z chorobami dziedzicznymi związanymi z niedoborem czynników krzepnięcia krwi. Wskaźnikami odpowiedniej terapii są jasna świadomość pacjenta, ciepła skóra, stabilna hemodynamika, brak ciężkiej tachykardii i duszności, wystarczająca diureza - w granicach 30-40 ml/h. 1. Transfuzja krwi Powikłania transfuzji krwi: zaburzenia potransfuzyjne układu krzepnięcia krwi, ciężkie reakcje pirogenne z obecnością zespołu hipertermicznego i dekompensacji sercowo-naczyniowej, reakcje anafilaktyczne, hemoliza erytrocytów, ostra niewydolność nerek itp. Podstawą większości powikłań jest reakcja odrzucenia przez ciało obcej tkanki. Nie ma wskazań do przetoczenia krwi pełnej w puszkach, ponieważ ryzyko wystąpienia reakcji poprzetoczeniowych i powikłań jest znaczne, ale najgroźniejsze jest wysokie ryzyko zakażenia biorcy. W przypadku ostrej utraty krwi podczas interwencji chirurgicznej i odpowiedniego uzupełnienia niedoboru BCC, nawet gwałtowny spadek hemoglobiny i hematokrytu nie zagraża życiu pacjenta, ponieważ zużycie tlenu w znieczuleniu jest znacznie zmniejszone, dopuszczalne jest dodatkowe natlenienie, pomaga hemodylucja zapobiegają występowaniu mikrozakrzepicy i mobilizacji erytrocytów z magazynu, zwiększają prędkość przepływu krwi itp. „Rezerwy” krwinek czerwonych, które człowiek z natury ma znacznie przewyższają rzeczywiste potrzeby, zwłaszcza w stanie spoczynku, w którym pacjent jest w tym czasie. Zalecenia dotyczące przetaczania krwi dawcy i erytrocytów podczas operacji. 1. Transfuzję masy erytrocytów przeprowadza się po przywróceniu BCC. 2. W obecności ciężkiej współistniejącej patologii, która może prowadzić do śmierci (na przykład ciężka niedokrwistość jest źle tolerowana w ciężkiej chorobie wieńcowej serca). 3. W obecności następujących wskaźników czerwonej krwi pacjenta: 70-80 g / l dla hemoglobiny i 25% dla hematokrytu, a liczba czerwonych krwinek wynosi 2,5 miliona. Wskazaniami do transfuzji krwi są: krwawienie i korekta hemostazy. Rodzaje erytrocytów: krew pełna, masa erytrocytów, EMOLT (masa erytrocytów oddzielona od leukocytów, płytki krwi z solą fizjologiczną). Krew podaje się dożylnie w kroplówce, stosując system jednorazowy, z szybkością 60-100 kropli na minutę, w objętości 30-50 ml/kg. Przed transfuzją krwi konieczne jest określenie grupy krwi i czynnika Rh biorcy i dawcy, przeprowadzenie testu na ich zgodność, a przy łóżku pacjenta wykonuje się test biologiczny na zgodność. Gdy wystąpi reakcja anafilaktyczna, transfuzja zostaje zatrzymana i rozpoczynają się działania mające na celu wyeliminowanie wstrząsu. Standardowy koncentrat płytek krwi jest zawiesiną dwukrotnie odwirowanych płytek krwi. Minimalna liczba płytek krwi wynosi 0,5 x 1012 na litr, leukocyty - 0,2 x 109 na litr. Charakterystyki hemostatyczne i przeżycie są najbardziej widoczne w ciągu następnych 12-24 godzin przygotowania, ale lek można zastosować w ciągu 3-5 dni od momentu pobrania krwi. Koncentrat płytek krwi służy do małopłytkowości (białaczka, aplazja szpiku kostnego), trombopatii z zespołem krwotocznym. 2. Żywienie pozajelitowe W ciężkich chorobach, którym towarzyszą poważne zaburzenia homeostazy, konieczne jest dostarczenie organizmowi energii i materiału plastycznego. Dlatego też, gdy odżywianie przez usta jest z jakiegokolwiek powodu upośledzone lub całkowicie niemożliwe, konieczne jest przeniesienie pacjenta na żywienie pozajelitowe. W stanach krytycznych o różnej etiologii najistotniejsze zmiany zachodzą w metabolizmie białek – obserwuje się intensywną proteolizę, zwłaszcza w mięśniach poprzecznie prążkowanych. W zależności od zaawansowania zachodzącego procesu białka ustrojowe są katabolizowane w ilości 75-150 g dziennie (dzienne straty białka przedstawiono w Tabeli 11). Prowadzi to do niedoboru aminokwasów egzogennych, które są wykorzystywane jako źródło energii w procesie glukoneogenezy, co skutkuje ujemnym bilansem azotowym. Tabela 11 Dzienna utrata białka w krytycznych warunkach
Utrata azotu prowadzi do zmniejszenia masy ciała, ponieważ: 1 g azotu \u6,25d 25 g białka (aminokwasów) \uXNUMXd XNUMX g tkanki mięśniowej. W ciągu jednego dnia od wystąpienia stanu krytycznego, bez odpowiedniej terapii z wprowadzeniem wystarczającej ilości niezbędnych składników odżywczych, wyczerpują się własne rezerwy węglowodanów, a organizm otrzymuje energię z białek i tłuszczów. W związku z tym przeprowadzane są nie tylko ilościowe, ale także jakościowe zmiany w procesach metabolicznych. Główne wskazania do żywienia pozajelitowego to: 1) anomalie w rozwoju przewodu pokarmowego (zarośnięcie przełyku, zwężenie odźwiernika i inne, okres przed- i pooperacyjny); 2) oparzenia i urazy jamy ustnej i gardła; 3) rozległe oparzenia ciała; 4) zapalenie otrzewnej; 5) porażenna niedrożność jelit; 6) przetoki w jelicie wysokim; 7) nieposkromione wymioty; 8) śpiączka; 9) ciężkie choroby, którym towarzyszą wzmożone procesy kataboliczne i niewyrównane zaburzenia metaboliczne (posocznica, ciężkie postacie zapalenia płuc); 10) atrofia i dystrofia; 11) anoreksja z powodu nerwic. Żywienie pozajelitowe powinno być prowadzone w warunkach kompensacji zaburzeń wolemiczno-elektrolitowych, eliminacji zaburzeń mikrokrążenia, hipoksemii i kwasicy metabolicznej. Podstawową zasadą żywienia pozajelitowego jest dostarczenie organizmowi odpowiedniej ilości energii i białka. Do celów żywienia pozajelitowego stosuje się następujące rozwiązania. Węglowodany: Najbardziej akceptowalnym lekiem stosowanym w każdym wieku jest glukoza. Stosunek węglowodanów w codziennej diecie powinien wynosić co najmniej 50-60%. Do pełnego wykorzystania wymagane jest utrzymanie szybkości podawania, glukoza powinna być dostarczana ze składnikami - insulina 1 jednostka na 4 g, potas, koenzymy zaangażowane w wykorzystanie energii: fosforan pirydoksalu, kokarboksylaza, kwas liponowy i ATP - 0,5-1 mg / kg dziennie dożylnie. Wysoko stężona glukoza odpowiednio podana nie powoduje diurezy osmotycznej i znacznego wzrostu poziomu cukru we krwi. Do żywienia azotem stosuje się wysokiej jakości hydrolizaty białkowe (aminosol, aminon) lub roztwory aminokwasów krystalicznych. Leki te z powodzeniem łączą aminokwasy egzogenne i nieistotne, są mało toksyczne i rzadko wywołują reakcję alergiczną. Dawki podawanych preparatów białkowych zależą od stopnia naruszenia metabolizmu białek. Przy zaburzeniach wyrównanych dawka podawanego białka wynosi 1 g/kg masy ciała na dzień. Dekompensacja metabolizmu białek, objawiająca się hipoproteinemią, obniżeniem stosunku albuminy do globuliny, zwiększeniem ilości mocznika w dobowym moczu, wymaga wprowadzenia zwiększonych dawek białka (3-4 g/kg/dobę) oraz terapii antykatabolicznej. Obejmuje hormony anaboliczne (retabolil, nerabolil - 25 mg domięśniowo 1 raz w 5-7 dni), budowanie programu żywienia pozajelitowego w trybie hiperalimentacji (140-150 kcal/kg masy ciała dziennie), inhibitory proteazy (kontrykal, trasylol 1000 U/kg dziennie przez 5-7 dni). Aby zapewnić odpowiednią przyswajalność tworzywa sztucznego, na każdy gram wprowadzonego azotu należy dostarczyć 200-220 kcal. Roztworów aminokwasów nie należy podawać ze stężonymi roztworami glukozy, ponieważ tworzą one toksyczne mieszaniny. Względne przeciwwskazania do wprowadzenia aminokwasów: niewydolność nerek i wątroby, wstrząs i niedotlenienie. Emulsje tłuszczowe zawierające wielonienasycone kwasy tłuszczowe stosuje się w celu poprawy metabolizmu tłuszczów oraz zwiększenia kaloryczności żywienia pozajelitowego. Tłuszcz jest produktem najbardziej kalorycznym, jednak do jego wykorzystania konieczne jest utrzymanie optymalnych dawek i szybkości podawania. Emulsji tłuszczowych nie należy podawać razem ze stężonymi roztworami polijonowej glukozy, a także przed i po nich. Przeciwwskazania do wprowadzenia emulsji tłuszczowych: niewydolność wątroby, lipemia, hipoksemia, stany wstrząsowe, zespół zakrzepowo-krwotoczny, zaburzenia mikrokrążenia, obrzęk mózgu, skaza krwotoczna. Wymagane dane dotyczące głównych składników do żywienia pozajelitowego podano w Tabeli 12 i Tabeli 13. Tabela 12 Dawki, stawki, kaloryczność głównych składników do żywienia pozajelitowego
Przepisując żywienie pozajelitowe konieczne jest wprowadzenie optymalnych dawek witamin biorących udział w wielu procesach metabolicznych, będących koenzymami w reakcjach wykorzystania energii. Tabela 13 Dawki witamin (w mg na 100 kcal) wymagane podczas żywienia pozajelitowego
Program żywienia pozajelitowego, prowadzonego w dowolnym trybie, powinien być opracowany pod kątem zbilansowanej proporcji składników. Optymalny stosunek białek, tłuszczów, węglowodanów to 1: 1,8: 5,6. Do rozkładu i włączenia białek, tłuszczów i węglowodanów w procesie syntezy potrzebna jest pewna ilość wody. Stosunek zapotrzebowania na wodę do kaloryczności pożywienia wynosi 1 ml H2O - 1 kcal (1: 1). Obliczenie zapotrzebowania na spoczynkowe zużycie energii (ERP) według Harris-Benedict: Mężczyźni – EZP = 66,5 + 13,7 x waga, kg + 5 x wzrost, cm - 6,8 x wiek (lata). Kobiety - EZP = 66,5 + 9,6 x waga, kg + 1,8 x wzrost, cm - 4,7 x wiek (lata). Wartość EZP, określona wzorem Harrisa-Benedicta, wynosi średnio 25 kcal/kg dziennie. Po obliczeniu wybiera się współczynnik aktywności fizycznej pacjenta (PFA), współczynnik aktywności metabolicznej (FMA) w oparciu o stan kliniczny oraz współczynnik temperatury (TF), za pomocą których zapotrzebowanie na energię (E) danego pacjent zostanie określony. Współczynniki do obliczania FFA, FMA i TF przedstawiono w tabeli 14. Tabela 14 Współczynnik do obliczania FFA, FMA i TF
Aby określić dzienny PE, wartość EZP mnoży się przez FFA, FMA i TF. 3. Terapia detoksykacyjna W ciężkim zatruciu konieczna jest aktywna terapia detoksykacyjna, mająca na celu wiązanie i usuwanie toksyn z organizmu. W tym celu najczęściej stosuje się roztwory poliwinylopirolidonu (neokompensan, gemodez) i żelatynolu, adsorbujące i neutralizujące toksyny, które są następnie wydalane przez nerki. Roztwory te podaje się kroplami w ilości 5-10 ml/kg masy ciała pacjenta, dodając do nich roztwór witaminy C i chlorku potasu w minimalnej ilości 1 mmol/kg masy ciała. Mafusol, który jest skutecznym środkiem przeciw niedotlenieniu i przeciwutleniaczem, ma również wyraźne właściwości detoksykujące. Dodatkowo poprawia mikrokrążenie i właściwości reologiczne krwi, co również przyczynia się do efektu detoksykacji. Przy różnych zatruciach jedną z najskuteczniejszych metod detoksykacji jest wymuszona diureza. Płyny dożylne w celu wymuszonej diurezy są przepisywane w ciężkich stopniach zatrucia i łagodniejszych, gdy pacjent odmawia picia. Przeciwwskazaniami do wymuszonej diurezy są: ostra niewydolność sercowo-naczyniowa oraz ostra niewydolność nerek (bezmocz). Przeprowadzenie wymuszonej diurezy wymaga ścisłego rozliczenia objętości i składu ilościowego wstrzykiwanego płynu, terminowego wyznaczenia diuretyków, jasnej kontroli klinicznej i biochemicznej. Jako główne rozwiązanie dla obciążenia wodą proponuje się: glukozę 14,5 g; chlorek sodu 1,2 g; wodorowęglan sodu 2,0 g; chlorek potasu 2,2 g; woda destylowana do 1000 ml. Ten roztwór jest izotoniczny, zawiera wymaganą ilość wodorowęglanu sodu, stężenie potasu w nim nie przekracza dopuszczalnego, a stosunek stężenia osmotycznego glukozy i soli wynosi 2: 1. W początkowej fazie wymuszonej diurezy wskazane jest również wprowadzenie roztworów substytucyjnych i odtruwających: albumina 8-10 ml/kg, hemodez lub neokompensan 15-20 ml/kg, mafusol 8-10 ml/kg, refortan lub infukol 6-8 ml/kg kg, reopoliglyukin 15-20 ml/kg. Całkowita ilość wstrzykniętych roztworów powinna w przybliżeniu 1,5 razy przekraczać dzienne zapotrzebowanie. Autor: Kolesnikova M.A.
▪ Filozofia. Notatki do wykładów
Otwarto najwyższe obserwatorium astronomiczne na świecie
04.05.2024 Sterowanie obiektami za pomocą prądów powietrza
04.05.2024 Psy rasowe chorują nie częściej niż psy rasowe
03.05.2024
▪ Transceiver światłowodowy Ethernet ▪ Android dla pojazdów Mercedes-Benz
▪ sekcja witryny A potem pojawił się wynalazca (TRIZ). Wybór artykułu ▪ Nikt nie pisze artykułu do pułkownika. Popularne wyrażenie ▪ artykuł Skąd się wzięły różne rasy psów? Szczegółowa odpowiedź ▪ artykuł Waleriana apteka. Legendy, uprawa, metody aplikacji ▪ artykuł Autokierunkowskaz z jedną lampą. Encyklopedia elektroniki radiowej i elektrotechniki
Strona główna | biblioteka | Artykuły | Mapa stony | Recenzje witryn www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

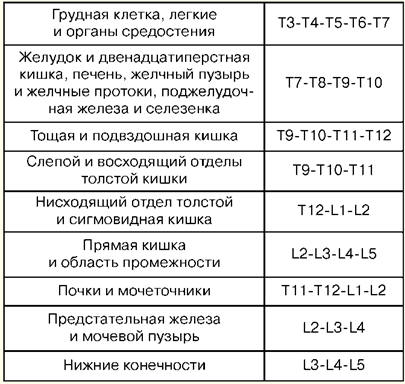












 Zobacz inne artykuły Sekcja
Zobacz inne artykuły Sekcja 